题目内容
FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
| A、都呈透明的红褐色 |
| B、都比较稳定,密封保存一段时间都不会产生沉淀 |
| C、分散质颗粒直径相同 |
| D、当有光线透过时,都能产生丁达尔效应 |
考点:胶体的重要性质
专题:溶液和胶体专题
分析:A.根据FeCl3溶液与Fe(OH)3胶体的颜色分析解答;
B.胶体具有介稳性,溶液具有稳定性;
C.溶液中溶质粒子小胶体粒子直径较大;
D.只有胶体具有丁达尔效应,溶液不具备.
B.胶体具有介稳性,溶液具有稳定性;
C.溶液中溶质粒子小胶体粒子直径较大;
D.只有胶体具有丁达尔效应,溶液不具备.
解答:
解:A.因FeCl3溶液与Fe(OH)3胶体的颜色分别为棕黄色、红褐色,故A错误;
B.胶体具有介稳性,放置不会产生沉淀,溶液是稳定的,故B正确;
C.Fe(OH)3胶体的分散质颗粒直径在1-100nm之间,FeCl3溶液的分散质颗粒直径小于1nm,分散质颗粒直径不相同,故C错误;
D.只有胶体具有丁达尔效应,所以Fe(OH)3胶体具有丁达尔效应,而FeCl3溶液不具备,故D错误;
故选B.
B.胶体具有介稳性,放置不会产生沉淀,溶液是稳定的,故B正确;
C.Fe(OH)3胶体的分散质颗粒直径在1-100nm之间,FeCl3溶液的分散质颗粒直径小于1nm,分散质颗粒直径不相同,故C错误;
D.只有胶体具有丁达尔效应,所以Fe(OH)3胶体具有丁达尔效应,而FeCl3溶液不具备,故D错误;
故选B.
点评:本题考查了胶体的性质以及胶体和溶液的区别,题目难度不大,掌握胶体的性质是解题的关键.

练习册系列答案
相关题目
用惰性电极电解2L、1mol/L的CuSO4溶液,在电路中通过0.5mol电子后,调换正、负极,电路中又通过了1mol电子,此时溶液中H+的浓度(假设溶液体积不变)是( )
| A、1.5mol/L |
| B、0.75mol/L |
| C、0.5mol/L |
| D、0.25mol/L |
 镁-过氧化氢燃料电池是具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4=MgSO4+2H2O,结构示意图如图所示,关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池是具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4=MgSO4+2H2O,结构示意图如图所示,关于该电池的叙述正确的是( )| A、电池内部可以使用MnO2作填料 |
| B、电池工作时,H+向Mg电极移动 |
| C、电池充电时,Mg应与电源的负极相连 |
| D、电池工作时,正极周围溶液的pH将不断变小 |
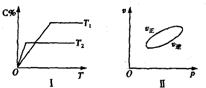 可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )| A、T1<T2,Q>0 |
| B、增大压强,物质B的转化率减小 |
| C、至反应达平衡时,混合气体的密度会变化 |
| D、a+b>c+d |
下列有关说法正确的是( )
| A、活化分子的总数越多,反应速率越快 |
| B、升高温度,活化分子百分数不变,活化分子数增多,化学反应速率增大 |
| C、使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率增大 |
| D、加入反应物,使活化分子百分数增大,化学反应速率增大 |
将0.2mol钠、镁、铝分别放入100mL1mol?L-1的盐酸中,产生的气体体积比是(气体体积在同温同压下测得)( )
| A、1:2:3 |
| B、6:3:2 |
| C、1:1:1 |
| D、2:1:1 |
下列叙述正确的是( )
| A、1.00 mol NaCl中含有6.02×1023个NaCl分子 |
| B、1.00 mol NaCl中,所有Na+的最外层电子总数为10×6.02×1023 |
| C、欲配置1.00L、1.00 mol.L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
| D、1mol Fe与稀硫酸反应Fe失去的电子数为2NA |
下列叙述正确的是( )
| A、稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 |
| B、Na2O2与水反应、红热的Fe与水蒸气反应均生成碱 |
| C、Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物 |
| D、CO2、HCl、NH3的水溶液都能导电,它们均属于电解质 |