题目内容
某化学反应的反应物和产物如下:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5①KMnO4的系数是
(3)在下面的化学式上标出电子转移的方向和数目MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
(4)通常用碳酸氢钠的饱和溶液除去CO2中混有的少量HCl气体,反应的离子方程式是 .不用碳酸钠稀溶液除杂的原因是(用离子方程式表示) .
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5①KMnO4的系数是
(3)在下面的化学式上标出电子转移的方向和数目MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
(4)通常用碳酸氢钠的饱和溶液除去CO2中混有的少量HCl气体,反应的离子方程式是
考点:氧化还原反应,氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:反应KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O中,Mn元素化合价降低,由+7价降低到+2价,被还原,KMnO4为氧化剂,I元素化合价升高,由-1价升高到0价和+5价,KI为还原剂,则氧化产物为I2和KIO3,结合氧化还原反应中氧化剂和还原剂之间得失电子数目相等配平方程式并标出电子转移的方向和数目,以此解答(1)~(3);
(4)碳酸氢钠与HCl反应生成二氧化碳,若利用碳酸钠除杂,二氧化碳与碳酸钠反应,将原物质反应掉.
(4)碳酸氢钠与HCl反应生成二氧化碳,若利用碳酸钠除杂,二氧化碳与碳酸钠反应,将原物质反应掉.
解答:
解:(1)KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,锰元素化合价由+7价降低为+2价,锰元素被还原,还原产物是MnSO4,KMnO4是氧化剂,
故答案为:KMnO4;
(2)如果该反应方程式中I2和KIO3的化学计量数都是5,则I元素失去电子的数目为2×5(1-0)+5×[5-(-1)]=40,则KMnO4的化学计量数应为
=8,
故答案为:8;
(3)结合质量守恒可知该反应化学方程式为8KMnO4+15KI+17H2SO4═8MnSO4+5I2+5KIO3+9K2SO4+17H2O,电子转移方向和数目可表示为 ,
,
故答案为: .
.
(4)碳酸氢钠与HCl反应生成二氧化碳,则除杂的离子反应为H++HCO3-=CO2↑+H2O,若利用碳酸钠除杂,二氧化碳与碳酸钠反应,将原物质反应掉,发生的离子反应为CO32-+CO2+H2O=2HCO3-,故答案为:H++HCO3-=CO2↑+H2O;CO32-+CO2+H2O=2HCO3-.
故答案为:KMnO4;
(2)如果该反应方程式中I2和KIO3的化学计量数都是5,则I元素失去电子的数目为2×5(1-0)+5×[5-(-1)]=40,则KMnO4的化学计量数应为
| 40 |
| 7-2 |
故答案为:8;
(3)结合质量守恒可知该反应化学方程式为8KMnO4+15KI+17H2SO4═8MnSO4+5I2+5KIO3+9K2SO4+17H2O,电子转移方向和数目可表示为
 ,
,故答案为:
 .
.(4)碳酸氢钠与HCl反应生成二氧化碳,则除杂的离子反应为H++HCO3-=CO2↑+H2O,若利用碳酸钠除杂,二氧化碳与碳酸钠反应,将原物质反应掉,发生的离子反应为CO32-+CO2+H2O=2HCO3-,故答案为:H++HCO3-=CO2↑+H2O;CO32-+CO2+H2O=2HCO3-.
点评:本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识相关概念并把握物质的性质,题目难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
下列各组原子中,彼此化学性质一定相似的是( )
| A、2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子 |
| B、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 |
| C、原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
| D、最外层都只有一个电子的X、Y原子 |
下列物质不能通过单质间化合反应直接生成的物质是( )
| A、FeCl2 |
| B、CuCl2 |
| C、NaCl |
| D、AlCl3 |
 镁-过氧化氢燃料电池是具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4=MgSO4+2H2O,结构示意图如图所示,关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池是具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4=MgSO4+2H2O,结构示意图如图所示,关于该电池的叙述正确的是( )| A、电池内部可以使用MnO2作填料 |
| B、电池工作时,H+向Mg电极移动 |
| C、电池充电时,Mg应与电源的负极相连 |
| D、电池工作时,正极周围溶液的pH将不断变小 |
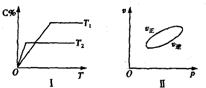 可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )| A、T1<T2,Q>0 |
| B、增大压强,物质B的转化率减小 |
| C、至反应达平衡时,混合气体的密度会变化 |
| D、a+b>c+d |
下列有关说法正确的是( )
| A、活化分子的总数越多,反应速率越快 |
| B、升高温度,活化分子百分数不变,活化分子数增多,化学反应速率增大 |
| C、使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率增大 |
| D、加入反应物,使活化分子百分数增大,化学反应速率增大 |
将0.2mol钠、镁、铝分别放入100mL1mol?L-1的盐酸中,产生的气体体积比是(气体体积在同温同压下测得)( )
| A、1:2:3 |
| B、6:3:2 |
| C、1:1:1 |
| D、2:1:1 |