题目内容
下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa)由此判断,正丁烷的燃烧热是( )
①C4H10(g)+
O2(g)═4CO2(g)+5H2O(l)△H=-2878KJ/mol
②C4H10(g)+
O2(g)═4CO2(g)+5H2O(g)△H=-2658KJ/mol
③C4H10(g)+
O2(g)═4CO(g)+5H2O(l)△H=-1746KJ/mol
④C4H10(g)+
O2(g)═4CO(g)+5H2O(g)△H=-1526KJ/mol.
①C4H10(g)+
| 13 |
| 2 |
②C4H10(g)+
| 13 |
| 2 |
③C4H10(g)+
| 9 |
| 2 |
④C4H10(g)+
| 9 |
| 2 |
| A、2 878 kJ/mol |
| B、2 658 kJ/mol |
| C、1 746 kJ/mol |
| D、1 526 kJ/mol |
考点:燃烧热
专题:化学反应中的能量变化
分析:燃烧热指1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,反应物中C→CO2(气),H→H2O(液),S→SO2(气)等.
解答:
解:正丁烷的燃烧热是1mol正丁烷完全燃烧生成CO2(气),H2O(液)放出的热量,故热化学方程式C4H10 (g)+O2(g)═4CO2(g)+5H2O(l)△H=-2878kJ/mol,符合燃烧热的概念,所以正丁烷的燃烧热为2878 kJ/mol.
故选:A.
故选:A.
点评:考查学生对燃烧热理解、对热化学方程式的理解,难度不大,注意热化学方程式中化学计量数表示物质的量,不表示个数.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
下列说法不正确的是( )
| A、同位素示踪法是科学家经常使用的研究化学反应历程的手段之一 |
| B、乙烷在1H核磁共振谱中只会在一个位置上出现特征峰 |
| C、红外光谱能够快速、微量、精确的测定相对分子质量 |
| D、“基团理论”认为有机化学中的“基”是一成不变的,这种说法是不正确的 |
已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1 H2(g)+O2(g)═H2O(l)△H=-285.8kJ?mol-1由此可知,在等温下蒸发36g液态水需吸收的热量( )
| A、483.6 kJ |
| B、88 kJ |
| C、285.8 kJ |
| D、44 kJ |
 镁-过氧化氢燃料电池是具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4=MgSO4+2H2O,结构示意图如图所示,关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池是具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4=MgSO4+2H2O,结构示意图如图所示,关于该电池的叙述正确的是( )| A、电池内部可以使用MnO2作填料 |
| B、电池工作时,H+向Mg电极移动 |
| C、电池充电时,Mg应与电源的负极相连 |
| D、电池工作时,正极周围溶液的pH将不断变小 |
在一定温度下,反应A2(气)+B2(气)?2AB(气)达到平衡状态的标志是( )
| A、单位时间里生成amolA2,同时消耗2amolAB |
| B、容器中的总压不随时间而变化 |
| C、A2,B2,AB浓度不随时间而变化 |
| D、v(A2):v(B2):v(AB)=1:1:2 |
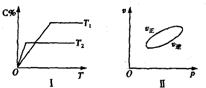 可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )| A、T1<T2,Q>0 |
| B、增大压强,物质B的转化率减小 |
| C、至反应达平衡时,混合气体的密度会变化 |
| D、a+b>c+d |
下列叙述正确的是( )
| A、相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 |
| B、等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 |
| C、常温常压下28 g CO与22.4 L O2所含分子数相等 |
| D、16 g CH4与18 g NH所含质子数相等 |