题目内容
2.H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂.某化学小组欲探究双氧水的性质做了如下实验:(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mLH2O2制取150mLO2所需的时间(秒)
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
②双氧水分解的方程式为2H2O2$\frac{\underline{催化剂}}{△}$2H2O+O2↑.
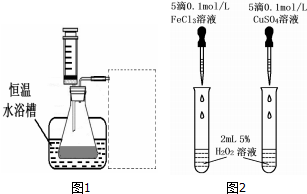
(2)另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30%H2O2、0.1mol?L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器.设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小).
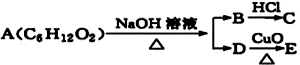
(3)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验.请回答相关问题:
①可通过观察反应产生气泡快慢,比较得出结论.
②有同学提出将0.1mol/L的FeCl3溶液改为0.05mol/LFe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰.
(4)已知 FeCl3溶液中主要含有 H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想:
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+
猜想 2:真正催化分解H2O2的是Cl-
完成表格验证猜想
| 所需试剂 | 操作及现象 | 结论 |
| Cl对H2O2分解无催化作用 |
分析 (1)①过氧化氢在常温下很难分解得到氧气,其分解速度受浓度、温度、催化剂等因素的影响设计实验方案来证明时,控制变量以确保实验结果的准确性;
②双氧水在催化剂、加热的条件下生成水和氧气;
(2)利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接;
(3)①根据反应生成气体的快慢分析;
②根据H2O2分解的催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,更为合理;
(4)由于双氧水溶液中有水,则可排除水作催化剂,根据猜想1可知猜想2应是真正催化分解H2O2的是Cl-;为验证猜想2可向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃,得出结论.
解答 解:(1)①根据表中给出的数据,无催化剂不加热的情况下,不同浓度的过氧化氢溶液都是几乎不反应,在无催化剂加热的情况下,不同浓度的过氧化氢溶液都分解,说明过氧化氢的分解速率与温度有关,但是得到相同气体的时间不同,浓度越大,反应的速度越快,说明过氧化氢的分解速率与浓度有关;比较同一浓度的过氧化氢溶液如30%时,在无催化剂加热的时候,需要时间是360s,有催化剂加热的条件下,需要时间是10s,说明过氧化氢的分解速率与温度、催化剂有关,
故答案为:温度、催化剂;
②双氧水在催化剂、加热的条件下生成水和氧气,反应方程式为:2H2O2$\frac{\underline{催化剂}}{△}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{催化剂}}{△}$2H2O+O2↑;
(2)利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接,装置图为: ,
,
故答案为: ;
;
(3)①该反应中产生气体,而且反应放热,所以可根据反应产生气泡快慢来判断,
故答案为:反应产生气泡快慢;
②H2O2催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,这样可以消除阴离子不同对实验的干扰,更为合理,
故答案为:消除阴离子不同对实验的干扰;
(4)由于双氧水溶液中有水,则可排除水作催化剂,根据猜想1可知猜想2应是真正催化分解H2O2的是Cl-;为验证猜想2可向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃,得出结论:Cl-对H2O2分解无催化作用,
故答案为:Cl-;
| 所需试剂 | 操作及现象 | 结论 |
| 双氧水,盐酸 | 向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃, |
点评 本题通过图表数据,考查了外界条件对反应速率的影响,注意利用控制变量法测定外界条件对反应速率的影响,难度中等.

 ,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )
,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
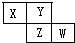 X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | Z元素的氧化物对应的水化物是强酸 | |
| B. | 含有X、Y、Z的化合物一定是共价化合物 | |
| C. | X的气态氢化物与W的气态氢化物反应的生成物中一定含有离子 | |
| D. | 原子半径大小顺序:X>Y>Z>W |
| A. | 18 g H2O含有10NA个质子 | |
| B. | 25℃时,PH=13的NaOH溶液中含有的OH- 数目为0.1NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
| A. | 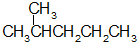 和 和 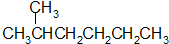 | |
| B. | H2N-CH2-COOH 和 H3C-CH2-NO2 | |
| C. | CH3-CH2-CH2-COOH 和 H3C-CH2-CH2-CH2-COOH | |
| D. | H3C-CH2-O-CH2-CH3和 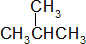 |
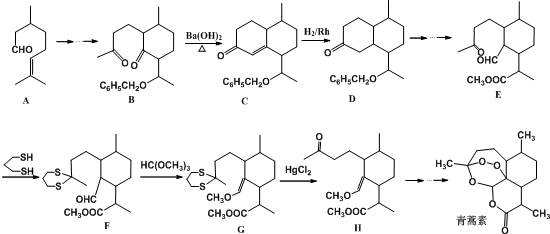
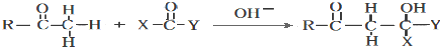
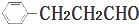 )的路线流程图.路线流程图示例如图:
)的路线流程图.路线流程图示例如图: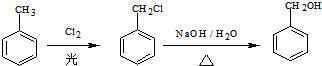
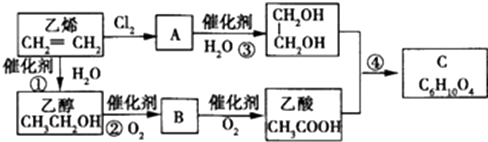
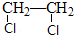 .
.