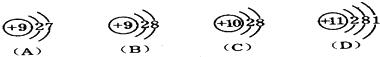题目内容
12.下列各组物质中,属于同分异构体的是( )| A. | 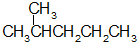 和 和 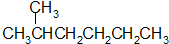 | |
| B. | H2N-CH2-COOH 和 H3C-CH2-NO2 | |
| C. | CH3-CH2-CH2-COOH 和 H3C-CH2-CH2-CH2-COOH | |
| D. | H3C-CH2-O-CH2-CH3和 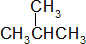 |
分析 A.两种烷烃所含碳原子数不同;
B.二者分子式相同,结构不同;
C.两种饱和一元羧酸所含碳原子数不同;
D.二者分子式不同.
解答 解:A.两种烷烃所含碳原子数不同,分子式不同,不是同分异构体,二者互为同系物,故A错误;
B.二者分子式相同,结构不同,互为同分异构体,故B正确;
C.两种饱和一元羧酸所含碳原子数不同,分子式不同,不是同分异构体,二者互为同系物,故C错误;
D.二者分子式不同,不是同分异构体,故D错误;
故选B.
点评 本题考查同分异构体,难度不大,根据分子式相同,结构不同即可判断,注意同分异构体与同系物的区别.

练习册系列答案
相关题目
2.H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂.某化学小组欲探究双氧水的性质做了如下实验:
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mLH2O2制取150mLO2所需的时间(秒)
①研究小组在设计方案时.考虑了浓度、温度、催化剂因素对过氧化氢分解速率的影响.
②双氧水分解的方程式为2H2O2$\frac{\underline{催化剂}}{△}$2H2O+O2↑.
(2)另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30%H2O2、0.1mol?L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器.设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小).
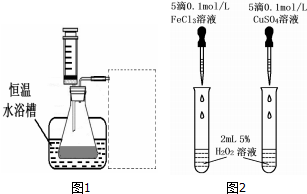
(3)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验.请回答相关问题:
①可通过观察反应产生气泡快慢,比较得出结论.
②有同学提出将0.1mol/L的FeCl3溶液改为0.05mol/LFe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰.
(4)已知 FeCl3溶液中主要含有 H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想:
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+
猜想 2:真正催化分解H2O2的是Cl-
完成表格验证猜想
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mLH2O2制取150mLO2所需的时间(秒)
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
②双氧水分解的方程式为2H2O2$\frac{\underline{催化剂}}{△}$2H2O+O2↑.
(2)另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30%H2O2、0.1mol?L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器.设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小).

(3)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验.请回答相关问题:
①可通过观察反应产生气泡快慢,比较得出结论.
②有同学提出将0.1mol/L的FeCl3溶液改为0.05mol/LFe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰.
(4)已知 FeCl3溶液中主要含有 H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想:
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+
猜想 2:真正催化分解H2O2的是Cl-
完成表格验证猜想
| 所需试剂 | 操作及现象 | 结论 |
| Cl对H2O2分解无催化作用 |
20.A是85号元素,试推测A和A的化合物最不可能具备的性质是( )
| A. | A易溶于某些有机溶剂 | B. | A的氢化物很不稳定 | ||
| C. | A是有色气体 | D. | A化银不溶于水或稀HNO3 |
7.12.8g Cu与过量的9mol/L 100mL HNO3反应,硝酸的还原产物为NO2和NO,反应结束后测得溶液中c(H+)=3mol/L,则反应后溶液中所含NO3-的物质的量( )
| A. | 0.3mol | B. | 0.5mol | C. | 0.7mol | D. | 0.75mol |
17.三氟化氮(NF3)是无色无味气体,它可由氟与氨直接反应得到:4NH3+3F2═NF3+3NH4F,下列叙述中正确的是( )
| A. | 在NF3中N的价态为-3价 | |
| B. | 该反应中NH3为还原剂,还原产物只有NF3 | |
| C. | 若有4 mol的氨气反应,转移的电子数目为6 NA | |
| D. | F2的摩尔质量为38 g |
1.下列过程属于物理变化的是( )
| A. | 石油分馏 | B. | 煤的气化 | C. | 煤的干馏 | D. | 海水提溴 |
5.阅读下面信息,推断元素,按要求回答问题:
| 信息 | 问题 |
| ①短周期元素X、Y、Z、W,原子序数依次增大,最外层电子数均不少于最内层电子数 | (1)X一定不是AD A.氢 B.碳 C.氧 D.硫 |
| ②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH溶液,氧化物的相对分子质量都大于26 | (2)这四种元素中有铝元素吗?可能 |
| ③向上述四种元素的单质的混合物中,加入足量的盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中有白色沉淀 | (3)白色沉淀的化学式为Mg(OH)2 |
| ④向上述四种元素的单质的混合物中,加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸,最终溶液中有白色沉淀 | (4)生成白色沉淀的离子方程式为SiO32-+2H+=H2SiO3↓(或SiO32-+2H++H2O=H4SiO4↓) |
| ⑤X与W同主族 | (5)X的最高价氧化物的电子式为 |

 它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.