题目内容
10.我国著名药学家屠呦呦因发现治疗疟疾新型药物青蒿素和双氢青蒿素而获2015年诺贝尔生理学或医学奖,震惊世界,感动中国.已知青蒿素的一种化学部分工艺流程如图: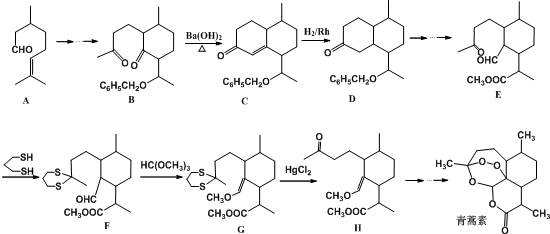
已知:
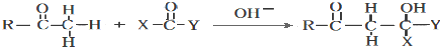
(1)下列有关说法中正确的是CD
A.青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基
B.青蒿素易溶于水,难溶于乙醇、苯等
C.青蒿素属于环状化合物,但不属于芳香族化合物
D.一定条件下,青蒿素能与氢氧化钠溶液反应
(2)化合物A中含有的非含氧官能团的名称是碳碳双键,请选择下列合适的试剂来检验该官能团,试剂加入的正确顺序为CBA.
A.溴水 B.稀盐酸 C.新制氢氧化铜悬浊液 D.氢氧化钠溶液
(3)该工艺流程中设计E→F、G→H的目的是保护羰基.
(4)反应B→C,实际上可看作两步进行.试根据已知信息写出依次发生反应的反应类型是加成反应、消去反应.
(5)M与A互为同系物,但比A少两个碳原子.满足下列条件的M的同分异构体有5种(不考虑立体异构).
①含有六元环 ②能发生银镜反应
(6)请结合所学知识和上述信息,写出由苯甲醛和氯乙烷为原料(无机试剂任用),制备苄基乙醛(
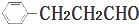 )的路线流程图.路线流程图示例如图:
)的路线流程图.路线流程图示例如图: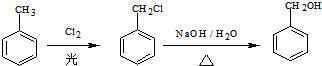
分析 A发生一系列反应生成B,B发生消去反应生成C,C发生加成反应生成D,D发生一系列反应生成E,E发生取代反应生成F,F发生反应生成G,G发生取代反应生成H,H反应一系列反应生成青蒿素,
(1)A.青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有过氧键;
B.青蒿素难溶于水,易溶于乙醇、苯等;
C.青蒿素含有环但不含苯环;
D.酯基能发生水解反应;
(2)化合物A中含有的非含氧官能团的名称是碳碳双键;用新制氢氧化铜悬浊液检验醛基、用稀盐酸将溶液酸化,然后用溴水检验碳碳双键;
(3)由E→F的结构可知,羰基中C=O双键变成C-S单键,由G→H的结构可知C-S单键又变成羰基,目的是保护羰基;
(4)由题目信息可知,结合B、C的结构可知,C=O双键变成C=C双键,应是B中连接羰基的甲基上的α-H与C=O先发生发生加成反应,再发生消去反应生成C;
(5)M与A互为同系物,但比A少两个碳原子,M含有8个C原子且含有碳碳双键和醛基,M的同分异构体符合下列条件:①含有六元环,②能发生银镜反应,说明含有醛基,则六元环上含有1个甲基和1个醛基或1个亚甲基和1个醛基;
(6)CH3CH2Cl在NaOH水溶液中加热发生取代反应生成CH3CH2OH,CH3CH2OH发生催化氧化生成CH3CHO,CH3CHO和苯甲醛反应生成苯丙烯醛,苯丙烯醛发生不完全加成反应生成苯丙醛.
解答 解:A发生一系列反应生成B,B发生消去反应生成C,C发生加成反应生成D,D发生一系列反应生成E,E发生取代反应生成F,F发生反应生成G,G发生取代反应生成H,H反应一系列反应生成青蒿素,
(1)A.青蒿素中含有过氧键,具有强氧化性,能氧化碘离子生成碘,碘遇淀粉变蓝色,所以青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有过氧键,故错误;
B.青蒿素中含有憎水基不含亲水基,所以难溶于水,易溶于乙醇、苯等,故B错误;
C.青蒿素含有环但不含苯环,所以青蒿素属于环状化合物,但不属于芳香族化合物
,故正确;
D.酯基能发生水解反应,故正确;
故选CD;
(2)化合物A中含有的非含氧官能团的名称是碳碳双键;用新制氢氧化铜悬浊液检验醛基、用稀盐酸将溶液酸化,然后用溴水检验碳碳双键,故答案为:碳碳双键; C B A;
(3)由E→F的结构可知,羰基中C=O双键变成C-S单键,由G→H的结构可知C-S单键又变成羰基,目的是保护羰基,
故答案为:保护羰基;
(4)由题目信息可知,结合B、C的结构可知,C=O双键变成C=C双键,应是B中连接羰基的甲基上的α-H与C=O先发生发生加成反应产生C-OH,再发生消去反应生成产生C=C双键生成C,
故答案为:加成反应;消去反应;
(5)M与A互为同系物,但比A少两个碳原子,M含有8个C原子且含有碳碳双键和醛基,M的同分异构体符合下列条件:①含有六元环,②能发生银镜反应,说明含有醛基,则六元环上含有1个-CH3和1个-CHO或1个-CH2-和1个醛基,如果取代基为-CH3和-CHO,有邻间对结构,亚甲基和醛基在同一个碳原子上,只含一个-CH2CHO取代基,所以符合条件的有5种,
故答案为:5;
(6)CH3CH2Cl在NaOH水溶液中加热发生取代反应生成CH3CH2OH,CH3CH2OH发生催化氧化生成CH3CHO,CH3CHO和苯甲醛反应生成苯丙烯醛,苯丙烯醛发生不完全加成反应生成苯丙醛,
其流程图为 ,
,
故答案为: .
.
点评 本题考查有机合成,为高频考点,侧重考查学生分析判断及知识综合应用能力,熟悉常见有机物官能团及其性质、有机反应类型及反应条件是解本题关键,注意醛之间反应断键和成键方式,题目难度不大.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
①A、C溶液显碱性,A、B的溶液中水的电离程度相同;
②C和D的溶液混合反应的现象只是有白色沉淀生成,B和C的溶液混合反应的现象只是有刺激性气味的气体生成,A和D的溶液混合无明显现象.
(1)A是CH3COONa,B是NH4Cl.
(2)写出C与D的溶液反应的离子方程式Ba2++SO42-=BaSO4↓.
| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 硅处于金属与非金属的过渡位置,硅可用作半导体材料 | |
| C. | 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
| A. | Al3+、NH4+、Cl?、HCO3? | B. | Na+、NO3-、SO42-、I? | ||
| C. | Na+、Mg2+、Cl?、SO42- | D. | Fe3+、K+、Cl?、NO3- |
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mLH2O2制取150mLO2所需的时间(秒)
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
②双氧水分解的方程式为2H2O2$\frac{\underline{催化剂}}{△}$2H2O+O2↑.
(2)另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30%H2O2、0.1mol?L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器.设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小).
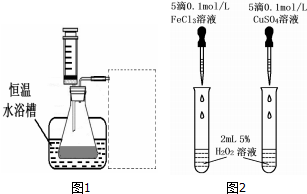
(3)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验.请回答相关问题:
①可通过观察反应产生气泡快慢,比较得出结论.
②有同学提出将0.1mol/L的FeCl3溶液改为0.05mol/LFe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰.
(4)已知 FeCl3溶液中主要含有 H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想:
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+
猜想 2:真正催化分解H2O2的是Cl-
完成表格验证猜想
| 所需试剂 | 操作及现象 | 结论 |
| Cl对H2O2分解无催化作用 |
部分短周期元素的原子半径及主要化合价
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6,-2 | +5,-3 | -2 |
| A. | GOH溶液和M(OH)3可以相互反应 | B. | 非金属性:T<Q | ||
| C. | 气态氢化物的稳定性:R>T | D. | L2+与T2-核外电子数相等 |
| A. | A易溶于某些有机溶剂 | B. | A的氢化物很不稳定 | ||
| C. | A是有色气体 | D. | A化银不溶于水或稀HNO3 |
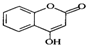 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: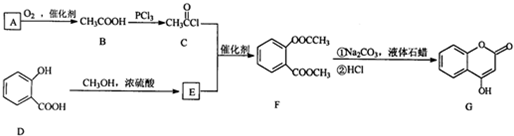
 .
. ,含有的化学键离子键、极性键.
,含有的化学键离子键、极性键.