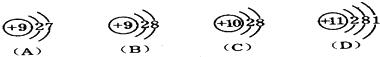题目内容
14.设NA为阿伏伽德常数的数值,下列说法正确的是( )| A. | 18 g H2O含有10NA个质子 | |
| B. | 25℃时,PH=13的NaOH溶液中含有的OH- 数目为0.1NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
分析 A.水分子中含10个质子,计算18g水物质的量计算质子数;
B.溶液体积不知不能计算微粒数;
C.标准状况气体摩尔体积为22.4L/mol,氨水是溶液;
D.常温下铁在浓硫酸中钝化不能继续进行;
解答 解:A.水分子中含10个质子,计算18g水物质的量=$\frac{18g}{18g/mol}$=1mol,计算质子数=1mol×10×NA=10NA,故A正确;
B.25℃时,PH=13的NaOH溶液中含有的OH- 溶液浓度为0.1mol/L,溶液体积不知不能计算微粒数,故B错误;
C.标准状况气体摩尔体积为22.4L/mol,氨水是溶液不能计算物质的量,故C错误;
D.常温下铁在浓硫酸中钝化不能继续进行,56 g铁片投入足量浓H2SO4中生成SO2分子远远小于NA个,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的理解应用,主要是微粒数和物质的量的计算、气体摩尔体积条件应用,掌握基础是解题关键,题目难度不大..

练习册系列答案
相关题目
5.根据原子结构及元素周期律的知识,下列叙述正确的是( )
| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 硅处于金属与非金属的过渡位置,硅可用作半导体材料 | |
| C. | 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
2.H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂.某化学小组欲探究双氧水的性质做了如下实验:
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mLH2O2制取150mLO2所需的时间(秒)
①研究小组在设计方案时.考虑了浓度、温度、催化剂因素对过氧化氢分解速率的影响.
②双氧水分解的方程式为2H2O2$\frac{\underline{催化剂}}{△}$2H2O+O2↑.
(2)另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30%H2O2、0.1mol?L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器.设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小).
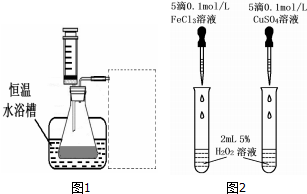
(3)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验.请回答相关问题:
①可通过观察反应产生气泡快慢,比较得出结论.
②有同学提出将0.1mol/L的FeCl3溶液改为0.05mol/LFe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰.
(4)已知 FeCl3溶液中主要含有 H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想:
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+
猜想 2:真正催化分解H2O2的是Cl-
完成表格验证猜想
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mLH2O2制取150mLO2所需的时间(秒)
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
②双氧水分解的方程式为2H2O2$\frac{\underline{催化剂}}{△}$2H2O+O2↑.
(2)另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30%H2O2、0.1mol?L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器.设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小).

(3)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验.请回答相关问题:
①可通过观察反应产生气泡快慢,比较得出结论.
②有同学提出将0.1mol/L的FeCl3溶液改为0.05mol/LFe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰.
(4)已知 FeCl3溶液中主要含有 H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想:
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+
猜想 2:真正催化分解H2O2的是Cl-
完成表格验证猜想
| 所需试剂 | 操作及现象 | 结论 |
| Cl对H2O2分解无催化作用 |
9.下列叙述正确的是( )
| A. | 用丁达尔现象实验可以区分食盐水和淀粉溶液 | |
| B. | 向氯化铁溶液中加入氢氧化钠溶液来制备Fe(OH)3胶体 | |
| C. | 硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价) 用氧化物形式表示:BaO•CuO•SiO2 | |
| D. | 某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物 |
19.据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6,-2 | +5,-3 | -2 |
| A. | GOH溶液和M(OH)3可以相互反应 | B. | 非金属性:T<Q | ||
| C. | 气态氢化物的稳定性:R>T | D. | L2+与T2-核外电子数相等 |
6.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氧化性:HClO>HClO4 | HClO4分子中非羟基氧原子数目较多 |
| B | 沸点:SiO2>CO2 | 相对分子质量越大沸点越高 |
| C | 密度:干冰>冰 | 干冰晶体属于分子密堆积 |
| D | 分解温度:MgO>NaCl | MgO晶格能大于NaCl |
| A. | A | B. | B | C. | C | D. | D |

 它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.