题目内容
17.某一有机物A可发生下列反应: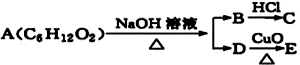 ,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )
,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 A能在碱性条件下反应生成B和D,B与酸反应,应为盐,D能在Cu催化作用下发生氧化,应为醇,则A应为酯,C和E都不能发生银镜反应,说明C、E不含醛基,如C为乙酸,则D为CH3CHOHCH2CH3,如C为丙酸,则D为CH3CHOHCH3,据此进行解答.
解答 解:A的分子式为C6H12O2,A能在碱性条件下反应生成B和D,B与酸反应,B应为盐,D能在Cu催化作用下发生氧化,D应为醇,则A属于酯,C和E都不能发生银镜反应,说明C、E不含醛基,则C不可能为甲酸,
若C为乙酸,则D为CH3CH(OH)CH2CH3,
若C为丙酸,则D为CH3CH(OH)CH3,
若C为丁酸,则D为乙醇、E为乙醛,不可能,
所以A只能为CH3COOCH(CH3)CH2CH3或CH3CH2COO2CH(CH3)2,总共有2种结构,
故选B.
点评 本题考查有机物的推断,题目难度不大,本题注意C和E都不能发生银镜反应的特点,为解答该题的关键,以此推断对应的酸或醇的种类和推断出A的可能结构.

练习册系列答案
相关题目
1. 瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是 Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是 Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
 瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是 Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是 Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )| A. | 瓦斯分析仪工作时,电池内电路中电子由电极b 流向电极a | |
| B. | 电极b 是正极,O2-由电极 a流向电极b | |
| C. | 电极a的反应式为:CH4+4O2--8e-=CO2+2H2O | |
| D. | 当固体电解质中有1 mol O2- 通过时,电子转移 4 mol |
5.根据原子结构及元素周期律的知识,下列叙述正确的是( )
| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 硅处于金属与非金属的过渡位置,硅可用作半导体材料 | |
| C. | 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
12.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使石蕊变红的溶液中:Na+、K+、AlO2-、HCO3- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=108的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、NH4+、NO3-、SO42- | |
| D. | 0.1 mol•L-1Fe2(SO4)3溶液中:Al3+、Ba2+、Cl-、OH- |
2.H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂.某化学小组欲探究双氧水的性质做了如下实验:
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mLH2O2制取150mLO2所需的时间(秒)
①研究小组在设计方案时.考虑了浓度、温度、催化剂因素对过氧化氢分解速率的影响.
②双氧水分解的方程式为2H2O2$\frac{\underline{催化剂}}{△}$2H2O+O2↑.
(2)另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30%H2O2、0.1mol?L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器.设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小).
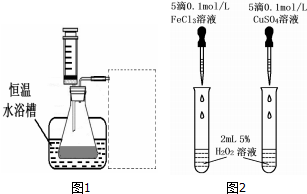
(3)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验.请回答相关问题:
①可通过观察反应产生气泡快慢,比较得出结论.
②有同学提出将0.1mol/L的FeCl3溶液改为0.05mol/LFe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰.
(4)已知 FeCl3溶液中主要含有 H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想:
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+
猜想 2:真正催化分解H2O2的是Cl-
完成表格验证猜想
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mLH2O2制取150mLO2所需的时间(秒)
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
②双氧水分解的方程式为2H2O2$\frac{\underline{催化剂}}{△}$2H2O+O2↑.
(2)另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30%H2O2、0.1mol?L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器.设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小).

(3)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验.请回答相关问题:
①可通过观察反应产生气泡快慢,比较得出结论.
②有同学提出将0.1mol/L的FeCl3溶液改为0.05mol/LFe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰.
(4)已知 FeCl3溶液中主要含有 H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想:
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+
猜想 2:真正催化分解H2O2的是Cl-
完成表格验证猜想
| 所需试剂 | 操作及现象 | 结论 |
| Cl对H2O2分解无催化作用 |
9.下列叙述正确的是( )
| A. | 用丁达尔现象实验可以区分食盐水和淀粉溶液 | |
| B. | 向氯化铁溶液中加入氢氧化钠溶液来制备Fe(OH)3胶体 | |
| C. | 硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价) 用氧化物形式表示:BaO•CuO•SiO2 | |
| D. | 某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物 |
6.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氧化性:HClO>HClO4 | HClO4分子中非羟基氧原子数目较多 |
| B | 沸点:SiO2>CO2 | 相对分子质量越大沸点越高 |
| C | 密度:干冰>冰 | 干冰晶体属于分子密堆积 |
| D | 分解温度:MgO>NaCl | MgO晶格能大于NaCl |
| A. | A | B. | B | C. | C | D. | D |
7.12.8g Cu与过量的9mol/L 100mL HNO3反应,硝酸的还原产物为NO2和NO,反应结束后测得溶液中c(H+)=3mol/L,则反应后溶液中所含NO3-的物质的量( )
| A. | 0.3mol | B. | 0.5mol | C. | 0.7mol | D. | 0.75mol |