题目内容
如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( ) 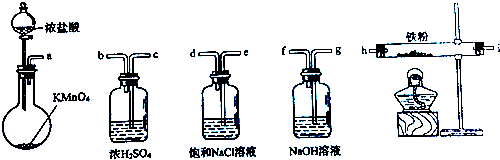

| A、a-b-c-d-e-e-f-g-h |
| B、a-e-d-c-b-h-i-g |
| C、a-d-e-c-b-h-i-g |
| D、a-c-b-d-e-h-i-f |
考点:化学实验操作的先后顺序
专题:化学实验基本操作
分析:实验室制备少量无水FeCl3需要用纯净、干燥的氯气在加热条件下与铁粉反应,在此过程中应注意氯气制取后的除杂和干燥,以及与铁粉反应后氯气尾气的处理等问题即可解答.
解答:
解:实验室制备少量无水FeCl3需要用纯净、干燥的氯气在加热条件下与铁粉反应,故首先要制备氯气,故最先使用的仪器是a;
制取出的氯气中有HCl和水蒸气,应先用饱和食盐水洗气除去HCl,而洗气时,气体要长进短出,故接下来的气流的方向是e→d;
然后用浓硫酸干燥氯气,故接下来的气流的方向是c→b;
制取了纯净干燥的氯气后,通入铁粉,在加热条件下与铁粉反应,故接下来连h;
氯气是污染性气体,对空气有污染,故应连接尾气处理装置,考虑到氯气是酸性气体,故要用碱液来吸收,故接下来通入NaOH 溶液,气流的方向是g→f;
故仪器连接顺序正确的是a-e-d-c-b-h-i-g,故选B.
制取出的氯气中有HCl和水蒸气,应先用饱和食盐水洗气除去HCl,而洗气时,气体要长进短出,故接下来的气流的方向是e→d;
然后用浓硫酸干燥氯气,故接下来的气流的方向是c→b;
制取了纯净干燥的氯气后,通入铁粉,在加热条件下与铁粉反应,故接下来连h;
氯气是污染性气体,对空气有污染,故应连接尾气处理装置,考虑到氯气是酸性气体,故要用碱液来吸收,故接下来通入NaOH 溶液,气流的方向是g→f;
故仪器连接顺序正确的是a-e-d-c-b-h-i-g,故选B.
点评:本题考查了仪器的连接顺序的问题,重点是掌握气体的除杂的方法和顺序,难度不大.

练习册系列答案
相关题目
把5.1g铝镁合金的粉末放入100mL某盐酸中,恰好完全反应得到5.6L H2(标准状况下).试计算:
(1)上述反应过程中,转移电子的物质的量;
(2)该盐酸的物质的量浓度;
(3)该合金中铝的质量分数.
(1)上述反应过程中,转移电子的物质的量;
(2)该盐酸的物质的量浓度;
(3)该合金中铝的质量分数.
aX(g)+bY(g)?cZ(g)+dW(g)在一定容积的密闭容器中反应,5min时达到平衡,X减少 n mol?L-1,Y减少
mol?L-1,Z增加
mol?L-1.若将体系压强增大,W的百分含量不发生变化.则化学方程式中各物质的化学计量数之比a:b:c:d应为( )
| n |
| 3 |
| 2n |
| 3 |
| A、3:1:2:1 |
| B、1:3:2:2 |
| C、1:3:1:2 |
| D、3:1:2:2 |
将20克NaOH固体溶解于足量水中,并通入足量CO2气体,生成的溶液中各微粒浓度关系正确的是( )
| A、c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| B、c(Na+)═c(HCO3-)+c(CO32-) |
| C、c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-) |
| D、c(OH-)═c(H +)+c(HCO3-)+c(H2CO3) |
下列有关各装置图及对应实验的描述正确的是( )
A、 电解精炼铝 |
B、 制备Fe(OH)2 |
C、 制得金属铁 |
D、 验证NaHC03和Na2C03的热稳定性 |
 一种新型锅炉水添加剂的分子结构如图所示,该添加剂能除去锅炉水中溶解的氧气.下列有关说法正确的是( )
一种新型锅炉水添加剂的分子结构如图所示,该添加剂能除去锅炉水中溶解的氧气.下列有关说法正确的是( )| A、该添加剂与尿素[CO(NH2)2]互为同系物 |
| B、分子中各原子的最外层均达到八电子稳定结构 |
| C、分子中所有原子共平面 |
| D、该添加剂具有还原性 |
下列装置中(杯中均盛有海水)能使铁受到保护不被腐蚀的是( )
A、 |
B、 |
C、 |
D、 |
下列物质是第三周期元素最高价氧化物对应的水化物(含氧酸),其中酸性就强的是( )
| A、H2SiO3 |
| B、H3PO4 |
| C、H2SO4 |
| D、HClO4 |