题目内容
把5.1g铝镁合金的粉末放入100mL某盐酸中,恰好完全反应得到5.6L H2(标准状况下).试计算:
(1)上述反应过程中,转移电子的物质的量;
(2)该盐酸的物质的量浓度;
(3)该合金中铝的质量分数.
(1)上述反应过程中,转移电子的物质的量;
(2)该盐酸的物质的量浓度;
(3)该合金中铝的质量分数.
考点:有关混合物反应的计算,化学方程式的有关计算
专题:计算题
分析:镁铝合金与盐酸发生反应的化学方程式为:Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,生成氢气的物质的量为:n(H2)=
=0.25mol,
(1)根据电子守恒计算出反应过程中转移电子的物质的量;
(2)设出镁、铝的物质的量,根据题中数据列式计算出合金中镁和铝的物质的量,再结合方程式计算出消耗氯化氢的物质的量,最后根据c=
计算出盐酸的物质的量浓度;
(3)根据质量分数的表达式计算出合金中铝的质量分数.
| 5.6L |
| 22.4L/mol |
(1)根据电子守恒计算出反应过程中转移电子的物质的量;
(2)设出镁、铝的物质的量,根据题中数据列式计算出合金中镁和铝的物质的量,再结合方程式计算出消耗氯化氢的物质的量,最后根据c=
| n |
| V |
(3)根据质量分数的表达式计算出合金中铝的质量分数.
解答:
解:(1)标准状况下5.6L氢气的物质的量为:n(H2)=
=0.25mol,
根据电子守恒,生成0.25mol氢气转移的电子的物质的量为:0.25mol×2=0.5mol,
答:反应过程中,转移电子的物质的量为0.5mol;
(2)设5.1g镁铝合金中含有镁xmol,含有铝ymol,则
Mg+2HCl=MgCl2+H2↑,
1 2 1
x 2x x
2Al+6HCl=2AlCl3+3H2↑,
2 6 3
y 3y
y
解得:
反应消耗的盐酸的总物质的量为:2x+3y=0.1mol×2+0.1mol×3=0.5mol,
盐酸的物质的量浓度为:c(HCl)=
=5mol/L,
答:该盐酸的物质的量浓度为5mol/L;
(3)该合金中铝的质量分数为:w(Al)=
×100%≈52.9%,
故:该合金中铝的质量分数为52.9%.
| 5.6L |
| 22.4L/mol |
根据电子守恒,生成0.25mol氢气转移的电子的物质的量为:0.25mol×2=0.5mol,
答:反应过程中,转移电子的物质的量为0.5mol;
(2)设5.1g镁铝合金中含有镁xmol,含有铝ymol,则
Mg+2HCl=MgCl2+H2↑,
1 2 1
x 2x x
2Al+6HCl=2AlCl3+3H2↑,
2 6 3
y 3y
| 3 |
| 2 |
|
解得:
|
反应消耗的盐酸的总物质的量为:2x+3y=0.1mol×2+0.1mol×3=0.5mol,
盐酸的物质的量浓度为:c(HCl)=
| 0.5mol |
| 0.1L |
答:该盐酸的物质的量浓度为5mol/L;
(3)该合金中铝的质量分数为:w(Al)=
| 27g/mol×0.1mol |
| 5.1g |
故:该合金中铝的质量分数为52.9%.
点评:本题考查了有关混合物的计算,题目难度中等,注意掌握物质的量浓度、质量分数的表达式,明确反应原理为解答本题的关键,试题培养了学生的分析、理解能力及计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关系正确的是( )
| A、沸点:苯酚>甲醛>2一甲基丁烷 |
| B、2,2,3,3-四甲基丁烷、新戊烷、乙烷中化学环境相同的H原子种类由多到少 |
| C、密度:溴苯>H2O>苯 |
| D、等物质的量物质燃烧耗O2量:己烷>苯>C6H5COOH |
两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况).则原混合物中Na2O2和NaHCO3的物质的量之比可能为( )
| A、3:2 | B、2:1 |
| C、9:2 | D、8:1 |
关于电解氯化钠溶液,下列叙述正确的是( )
| A、电解时在阳极得到氯气,在阴极得到金属钠 |
| B、在阳极附近有黄绿色的气体产生 |
| C、在阴极附近的溶液中滴入酚酞溶液,溶液呈无色 |
| D、电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性 |
由两种气态烃组成的混合气体,其所含碳元素和氢元素的质量之比为24:3,则混合气体的组成及其体积比可能是( )
| A、CH4和C3H4,体积比为1:1 |
| B、C2H2和C2H6,体积比为3:1 |
| C、C2H4和C2H6,体积比为2:1 |
| D、C2H2 和C2H4,体积比为2:3 |
0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
| A、c(H+)>c(F-) |
| B、c(H+)>c(HF) |
| C、c(OH-)>c(HF) |
| D、c(HF)>c(F-) |
 对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )
对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )| A、X、Y、Z、W均为气体 |
| B、Z、W为气体,X、Y中之一为气体 |
| C、X、Y、Z皆为气体,W为非气体 |
| D、X、Y为气体,Z、W中至少有一种为气体 |
如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( ) 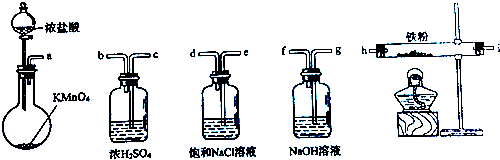

| A、a-b-c-d-e-e-f-g-h |
| B、a-e-d-c-b-h-i-g |
| C、a-d-e-c-b-h-i-g |
| D、a-c-b-d-e-h-i-f |