题目内容
取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100mL后,恰好完全反应,过滤、干燥后得到17.645g白色沉淀和滤液(溶液体积为200mL),再用过量稀硝酸处理沉淀,最后减少到5.825g,并有气体放出.计算[第(3)问请写出计算过程]:
(1)原混合液中Na2SO4的物质的量浓度为 mol/L;
(2)产生的气体在标准状况下的体积为 L;
(3)过滤出沉淀后,计算所得滤液的物质的量浓度为多少?
(1)原混合液中Na2SO4的物质的量浓度为
(2)产生的气体在标准状况下的体积为
(3)过滤出沉淀后,计算所得滤液的物质的量浓度为多少?
考点:有关混合物反应的计算
专题:计算题
分析:过滤、干燥后得到17.645g白色沉淀为碳酸钡、硫酸钡的质量,用足量的稀硝酸处理沉淀后,不溶于稀硝酸的5.825g沉淀为硫酸钡,故碳酸钡质量为17.645g-5.825g=11.82g,
(1)根据n=
计算硫酸钡的物质的量,根据硫酸根守恒有n(Na2SO4)=n(BaSO4),再根据c=
计算原混合液中Na2SO4的物质的量浓度;
(2)根据n=
计算碳酸钡的物质的量,生成的气体为二氧化碳,根据碳元素守恒有n(CO2)=n(BaCO3),再根据V=nVm计算二氧化碳的体积;
(3)过滤后,所得溶液为NaOH溶液,由钠离子守恒可知n(NaOH)=2n(Na2CO3)+2n(Na2SO4),进而计算c(NaOH).
(1)根据n=
| m |
| M |
| n |
| V |
(2)根据n=
| m |
| M |
(3)过滤后,所得溶液为NaOH溶液,由钠离子守恒可知n(NaOH)=2n(Na2CO3)+2n(Na2SO4),进而计算c(NaOH).
解答:
解:过滤、干燥后得到17.645g白色沉淀为碳酸钡、硫酸钡的质量,用足量的稀硝酸处理沉淀后,不溶于稀硝酸的5.825g沉淀为硫酸钡,故碳酸钡质量为17.645g-5.825g=11.82g,
(1)根据硫酸根守恒,有n(Na2SO4)=n(BaSO4)=
=0.025mol,原混合液中Na2SO4的物质的量浓度为
=0.25mol/L,
故答案为:0.25;
(2)根据碳元素守恒,有n(CO2)=n(BaCO3)=
=0.06mol,故V(CO2)=0.06mol×22.4L/mol=1.334L,
故答案为:1.334;
(3)过滤后,所得溶液为NaOH溶液,由钠离子守恒可知n(NaOH)=2n(Na2CO3)+2n(Na2SO4)=2×0.06mol+2×0.025mol=0.17mol,故滤液的物质的量浓度为
=0.85mol/L,
答:滤液的物质的量浓度为0.85mol/L.
(1)根据硫酸根守恒,有n(Na2SO4)=n(BaSO4)=
| 5.825g |
| 233g/mol |
| 0.025mol |
| 0.1L |
故答案为:0.25;
(2)根据碳元素守恒,有n(CO2)=n(BaCO3)=
| 11.82g |
| 197g/mol |
故答案为:1.334;
(3)过滤后,所得溶液为NaOH溶液,由钠离子守恒可知n(NaOH)=2n(Na2CO3)+2n(Na2SO4)=2×0.06mol+2×0.025mol=0.17mol,故滤液的物质的量浓度为
| 0.17mol |
| 0.2L |
答:滤液的物质的量浓度为0.85mol/L.
点评:本题考查混合物、有关方程式的计算,难度不大,明确发生的反应即可解答,(3)中注意利用守恒计算,较好的考查学生的分析计算能力.

练习册系列答案
相关题目
0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
| A、c(H+)>c(F-) |
| B、c(H+)>c(HF) |
| C、c(OH-)>c(HF) |
| D、c(HF)>c(F-) |
在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃不可能是( )
| A、CH4和C2H4 |
| B、C2H2和C2H6 |
| C、C2H4和C3H4 |
| D、C4H8和C3H6 |
如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( ) 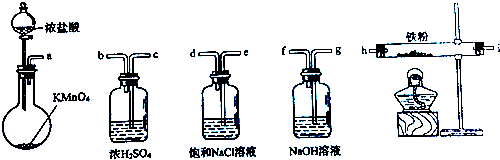

| A、a-b-c-d-e-e-f-g-h |
| B、a-e-d-c-b-h-i-g |
| C、a-d-e-c-b-h-i-g |
| D、a-c-b-d-e-h-i-f |
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生.下列有关说法正确的是( )
| A、达到化学平衡时,N2将完全转化为NH3 |
| B、达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C、达到化学平衡时,正反应和逆反应的速率都为零 |
| D、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
氢氧燃料电池用于航天飞机,以30%KOH溶液为电解质溶液的这种电池在使用时,下列说法错误的是( )
| A、H2在负极发生的电极反应是:2H2+4OH--4e-═4H2O |
| B、供电时的总反应为:2H2+O2═2H2O |
| C、O2正极的电极反应是:O2+2H2O+4e-═4OH- |
| D、燃料电池的能量转化率可达100% |
下列属于第ⅣA的元素的是( )
| A、C | B、N | C、O | D、S |
 在密闭容器中加入等浓度的CO与H2O,T℃时发生如下反应:
在密闭容器中加入等浓度的CO与H2O,T℃时发生如下反应: