题目内容
4.增强环保意识.爱护环境是每个公民的职责.利用碳的氧化物合成甲醇等资源化利用对环境保护具有重要意义.请回答下列问题:(1)溶于海水的CO2有4种存在形式.其中HCO3-占95%,除上述两种形式外,碳的存在形式还有H2CO3、CO32- (填微粒符号);利用图1装置进行的实验中,a室的电极反应式为2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑.
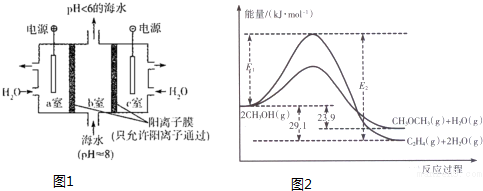
(2)下列为合成甲醇的有关化学方程式
①2H2(g)+CO(g)?CH3OH(g)
②H2(g)+CO2(g)?H2O(g)+CO(g)
③3H2(g)+CO2(g)?CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为5.0.
(3)一定条件下,甲醇可同时发生:
A.2CH3OH(g)═CH3OCH3+H2O(g)
B.2CH3OH(g)═C2H4(g)+2H2O(g).
上述反应过程中能量变化如图2所示:
①写出反应速率较大的序号并说明原因A;该反应的活化能较小,在相同条件下反应速率较大.
②若在容器中加入催化剂,则E2-E1将不变〔填“变大”、“不变”或“变小”〕.
(4)一定温度时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,发生反应2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol,测得达平衡时的有关数据如下表:
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2molH2(g) 1molCO(g) | 1mol CH3OH(g) | 2mol CH3OH(g) | |
| 平衡 | c(CH3OH)/mol/•L-1 | c1 | c2 | c3 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 | |
②在温度不变、恒容条件下,该反应的平衡常数数值Kp=4.80×10-2,若甲容器中反应达平衡状态时,p(CH3OH)=24.0kPa,则平衡时,混合气体中CH3OH的物质的量分数为61.5% (Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数).
分析 (1)二氧化碳溶于水生成碳酸,碳酸为弱酸,部分电离生成碳酸氢根;a室接电源的正极,为阳极,水失去电子生成氧气和氢离子;
(2)将①2H2(g)+CO(g)?CH3OH(g)与②H2(g)+CO2(g)?H2O(g)+CO(g)两方程式相加,即K3=K1×K2;
(3)①如图分析可知,反应的活化能越小反应速率越快;
②加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变;
(4)①甲、乙是等效平衡,丙等效为在乙的基础上增大压强,生成1molCH3OH的能量变化为90kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,计算反应热数值:甲、乙处于相同的平衡状态,则:|Q1|+|Q2|=90kJ;比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动;
②由2H2(g)+CO(g)?CH3OH(g)起始反应物投入量2mol H2、l mol CO,设开始时氢气压强为2P,CO压强为P,列三段式,根据平衡常数Kp=4.80×10-2,计算出平衡时的总压,最后根据CH3OH的物质的量分数为$\frac{分压}{总压}$进行计算.
解答 解:(1)二氧化碳溶于水生成碳酸,碳酸为弱酸,部分电离生成碳酸氢根;a室发生氧化反应:2H2O-4e-=4H++O2↑或4OH--4e-=2H2O+O2↑,
故答案为:H2CO3、CO32-;2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑;
(2)将①2H2(g)+CO(g)?CH3OH(g)与②H2(g)+CO2(g)?H2O(g)+CO(g)两方程式相加得:③3H2(g)+CO2(g)?CH3OH(g)+H2O(g),即K3=K1×K2=2.5×2.0=5.0,
故答案为:5.0;
(3)①反应的活化能越小反应速率越快,在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应中反应A和B相比,反应A的活化能小、反应速率快,
故答案为:A;该反应的活化能较小,在相同条件下反应速率较大;
②加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2的变化是减小,催化剂不改变反应物总能量与生成物总能量之差即反应热不变,E2-E1的大小为反应的焓变,活化能大小对该反应的反应热无影响,
故答案:不变;
(4)①甲、乙是等效平衡,丙等效为在乙的基础上增大压强,生成1molCH3OH的能量变化为90kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,|Q1|═90n,等于乙容器|Q2|=90(1-n),故|Q1|+|Q2|=90;
甲、乙处于相同的平衡状态,比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动,所以2c2<c3,
故答案为:90;<;
②由:2H2(g)+CO(g)?CH3OH(g)起始反应物投入量2mol H2、l mol CO,设开始时氢气压强为2P,CO压强为P,
开始(kPa) 2P P 0
转化(kPa)48.0 24.0 24.0
平衡(kPa)2P-48 P-24 24
Kp=$\frac{24}{(2p-48)^{2}×(p-24)}$=4.80×10-2,解得P=29.0kPa,则平衡混合气体中CH3OH的物质的量分数为$\frac{分压}{总压}$=$\frac{24}{15+24}$×100%=61.5%,
故答案为:61.5%.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量关系及变化是解本题关键,注意(4)题等效平衡构建,为易错点及难点.平衡常数的相关计算,难度较大.

| A. | υ(A)=0.5mol•L-1•S-1 | B. | υ(B)=0.3 mol•L-1•S-1 | ||
| C. | υ(C)=0.8mol•L-1•S-1 | D. | υ(D)=1 mol•L-1•S-1 |
| A. | 第3周期ⅡB族 | B. | 第4周期ⅡB族 | C. | 第4周期ⅦB族 | D. | 第4周期Ⅷ族 |
用CO和H2制甲醇的反应:CO(g)+2H2(g)?CH3OH (g)△H=-99kJ•mol-1
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能/kJ.mol-1 | a | b | x | c | d |
(2)在容积为1L的恒容容器中,分别研究在T1、T2、T3三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率α(CO)的关系如图1所示:
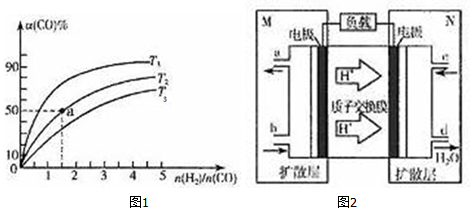
①T1、T2、T3中,温度最高的是T3.
②利用图中a点对应的数据,计算该反应在T2温度下的平衡常数K=4L2•mol-2.
若改变条件c(填序号),可使K=6L2•mol-2,
a.增大压强 b增大反应物的浓度
c.降低温度 d.减小$\frac{n({H}_{2})}{n(CO)}$
(3)用甲醇作燃料电池,其工作原理如图2所示.
①M区发生反应的电极反应式CH3OH+H2O-6e-=CO2+6H+.
②维持电流强度为0.5A,电池工作10分钟,理论上消耗甲醇$\frac{0.5×600}{96500×6}×32$g.(已知F=96500C•mol-1,写出计算表达式即可)
 在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )
在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )| A. | p3<p4,Y轴表示A的转化率 | |
| B. | p3>p4,Y轴表示混合气体的密度 | |
| C. | p3<p4,Y轴表示B的浓度 | |
| D. | p3>p4,Y轴表示混合气体的平均摩尔质量 |
 .
.