题目内容
1.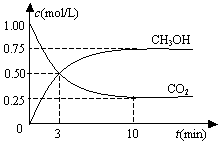 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
| A. | 反应进行到3 min时,该反应达到平衡状态 | |
| B. | 从反应开始到平衡,CO2的转化率为25% | |
| C. | 第3 min时,氢气的平均反应速率为1.5mol/(L•min) | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
分析 A、化学反应达到平衡状态时,正逆反应速率相等;
B、从反应开始到平衡,CO2的转化率等于变化量和初始量的比值;
C、计算第3 min二氧化碳的平均反应速率,结合物质表示的速率之比等于系数之比来计算氢气的平均反应速率;
D、计算平衡时氢气、水的浓度,再根据K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$计算平衡常数.
解答 解:A、反应进行到3 min时,各物质的浓度仍在变化,该反应正逆反应不速率相等,没有达到平衡状态,故A错误;
B、平衡时甲醇为0.75mol/L、二氧化碳为0.25mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度(mol/L):1 3 0 0
变化浓度(mol/L):0.75 2.25 0.75 0.75
平衡浓度(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,CO2的转化率=$\frac{0.75mol/L}{1mol/L}×100%$=75%,故B错误;
C、第3 min二氧化碳的平均反应速率v=$\frac{1mol/L-0.5mol/L}{3min}$=$\frac{0.5}{3}$mol/(L•min),各个物质表示的速率之比等于系数之比来,所以氢气的平均反应速率是0.5mol/(L•min),故C错误;
D、平衡时甲醇为0.75mol/L、二氧化碳为0.25mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度(mol/L):1 3 0 0
变化浓度(mol/L):0.75 2.25 0.75 0.75
平衡浓度(mol/L):0.25 0.75 0.75 0.75
K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$,故D正确.
故选D.
点评 本题考查化学平衡计算与影响因素、化学反应速率、平衡常数等,难度不大,侧重考查分析计算能力、读图获取信息能力.

(1)已知:
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
(2)在容积可变的密闭容器中充入1mol CO ( g ) 和2molH2 ( g )生成CH3OH( g ),H2的平衡转化率随温度(T)、压强(P)的变化如图1所示.
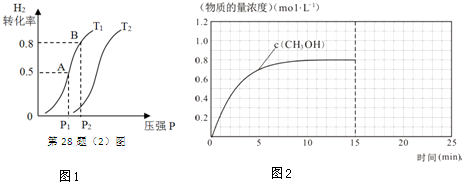
①该反应的△S<0,图中的T1<T2(填“<”、“>”或“=”).
②当达到平衡状态A 时,容器的体积为2L,此时该反应的平衡常数为4,若达到平衡状态B 时,则容器的体积V(B)=0.4L.
③在该容器中,下列措施可增加甲醇产率的是B.
A.升高温度 B.从平衡体系中及时分离CH3OH
C.充入He D.再充入0.5mol CO和1mol H2
(3)在容积固定为2L的密闭容器中充入2molCO( g )和6molH2( g )生成CH3OH( g ),反应时间与物质的量浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率为0.16mol•L-1•min-1;若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图2中画出15-25分钟c (CO)的变化曲线.
| A. | 1 mol H2中含有6.02×1023个H | B. | 1 mol氧含有6.02×1023个O2 | ||
| C. | 1 mol CaCl2溶液里含有1 mol离子 | D. | 1 mol H+中含有H+数为NA |
| A. | Fe2O3 是还原剂 | B. | CO是氧化剂 | ||
| C. | 氧化剂得到6mol电子 | D. | 还原剂失去8mol电子 |
| A. | 醛基的结构简式-COH | B. | 聚丙烯的结构简式  | ||
| C. | 四氯化碳分子的电子式  | D. | 丙烷分子的球棍模型  |
| A. | υ(A)=0.5mol•L-1•S-1 | B. | υ(B)=0.3 mol•L-1•S-1 | ||
| C. | υ(C)=0.8mol•L-1•S-1 | D. | υ(D)=1 mol•L-1•S-1 |
①加H2O
②加NaOH固体
③加CH3COONa固体
④加Na2CO3固体
⑤加入NaNO3固体
⑥加NaCl溶液
⑦滴入几滴硫酸铜溶液
⑧升高温度
⑨将块状铁改为铁粉
⑩将稀硫酸改用98%的浓硫酸.
| A. | ⑧⑨⑩ | B. | ⑦⑧⑨ | C. | ③⑦⑩ | D. | ⑦⑧⑩ |
| A. | 胶体的分散质能透过滤纸 | B. | 胶体粒子直径在1nm~100nm之间 | ||
| C. | 胶体具有丁达尔现象 | D. | 胶体和其它分散系都是混合物 |