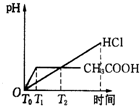
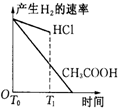
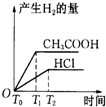
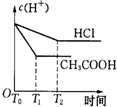
题目内容
14.已知PbCl2是微溶化合物,溶于水存在下列平衡:PbCl2(s)?Pb2+(aq)+2Cl-(aq),Ksp=1.7×10-5,在0.1 mol/L的AlCl3溶液中加入PbCl2固体,Pb2+的物质的量浓度最大可达到 ( )| A. | 1.7×10-3 mol/L | B. | 1.9×10-4mol/L | C. | 1.7×10-4mol/L | D. | 5.7×10-5mol/L. |
分析 0.1 mol/L的AlCl3溶液中c(Cl-)=0.3mol/L,结合Ksp=c(Pb2+)×c2(Cl-)=1.7×10-5计算Pb2+的物质的量浓度.
解答 解:0.1 mol/L的AlCl3溶液中c(Cl-)=0.3mol/L,由Ksp=c(Pb2+)×c2(Cl-)=1.7×10-5可知c(Pb2+)=$\frac{1.7×1{0}^{-5}}{(0.3)^{2}}$mol/L=1.9×10-4mol/L,
故选B.
点评 本题考查难溶电解质的溶解平衡的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握计算公式的运用,难度中等.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 酸碱中和滴定终点的pH值一定等于7 | |
| B. | 滴定实验中锥形瓶不可用待测液润洗 | |
| C. | 滴定实验中,KMnO4溶液应放在碱式滴定管中 | |
| D. | 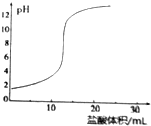 用盐酸滴定NaOH溶液的滴定曲线如图所示 |
8.甲醇是一种重要的化工原料,广泛应用于化工生产,也可直接用作燃料.已知:
CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=-443.64kJ•mol-1;
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1.
下列说法或热化学方程式正确的是( )
CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=-443.64kJ•mol-1;
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1.
下列说法或热化学方程式正确的是( )
| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1 | |
| D. | 完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ |
2.关于氢键,下列说法正确的是( )
| A. | 每一个水分子内含有两个氢键 | |
| B. | 氢键只能存在于分子之间 | |
| C. | DNA中的碱基互补配对是通过氢键来实现的 | |
| D. | HF是一种非常稳定的化合物,这是由氢键所致 |
9.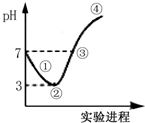 常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
 常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 从反应开始至②点,发生反应的离子方程式为:Cl2+H2O═ClO-+2H++Cl- | |
| B. | ③处表示氯气和NaOH溶液恰好完全反应 | |
| C. | ②点所表示的溶液中所存在的具有氧化性的含氯元素的微粒主要有:Cl2、HClO、ClO- | |
| D. | 从反应开始至②点可用pH试纸测定溶液的pH |
3.氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)?Cl2(aq) K1=10-1.2
Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示.下列表述正确的是( )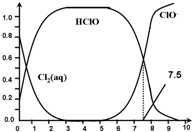
Cl2(g)?Cl2(aq) K1=10-1.2
Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示.下列表述正确的是( )

| A. | Cl2(g)+H2O?2H++ClO-+Cl- K=10-12.1 | |
| B. | 在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-) | |
| C. | 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好 | |
| D. | 氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
4.X、Y、Z均为短周期主族元素,X为地壳中含量最高的金属元素,Y的L层电子数等于K层电子数的3倍,Z元素M层电子数为7,下列有关说法不正确的是( )
| A. | X与Y形成的化合物既能与盐酸反应也能与氢氧化钠反应 | |
| B. | X的原子半径大于Z的原子半径 | |
| C. | X与Z形成的化合物的水溶液中逐滴滴加氨水至过量,先产生白色沉淀后沉淀溶解 | |
| D. | Z的最高价氧化物对应的水化物为强酸 |