题目内容
5.根据表中信息判断,下列叙述正确的是( )| 序号 | 反应物 | 产物 |
| ① | Na2O2、MnO4-、H+ | Mn2+、O2、H2O、Na+ |
| ② | Na2O2、H2O | NaOH、O2 |
| ③ | Na2O2、FeSO4 | Na2FeO4 |
| A. | 三组中Na2O2均作氧化剂 | |
| B. | 第②组反应中生成1molO2,转移电子的物质的量为4mol | |
| C. | 第③组反应中产物还有Na2SO4 | |
| D. | 氧化性的强弱顺序为Na2O2>MnO4->FeO42- |
分析 ①反应物为Na2O2、MnO4-、H+,生成物为Mn2+、O2、H2O、Na+,说明MnO4-将Na2O2氧化生成氧气,则MnO4-为氧化剂,Na2O2还原剂;
②2Na2O2+2H2O=4NaOH+O2,Na2O2既作氧化剂又作还原剂,生成1molO2,转移电子的物质的量为2mol;
③反应物为Na2O2、FeSO4,生成物为Na2FeO4,说明Na2O2将FeSO4氧化生成Na2FeO4,则Na2O2为氧化剂,FeSO4还原剂;
据此分析解答.
解答 解:A.①反应物为Na2O2、MnO4-、H+,生成物为Mn2+、O2、H2O、Na+,说明MnO4-将Na2O2氧化生成氧气,则MnO4-为氧化剂,Na2O2还原剂,②2Na2O2+2H2O=4NaOH+O2,Na2O2既作氧化剂又作还原剂,故A错误;
B.②2Na2O2+2H2O=4NaOH+O2,Na2O2既作氧化剂又作还原剂,生成1molO2,转移电子的物质的量为2mol,故B错误;
C.③反应物为Na2O2、FeSO4,生成物为Na2FeO4,方程式为2Na2O2+FeSO4=Na2FeO4+Na2SO4,故C正确;
D.由①说明MnO4-将Na2O2氧化生成氧气,说明氧化性MnO4->Na2O2,由③说明氧化性Na2O2>Na2FeO4,则氧化性的强弱顺序为MnO4->Na2O2>FeO42-,D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
15.二氧化碳与一氧化碳的混合气体共10.8g,其物质的量为0.3mol.则下列叙述不正确的是( )
| A. | 混合气体中二氧化碳与一氧化碳的物质的量各为1:1 | |
| B. | 混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是一氧化碳 | |
| C. | 混合气体的平均相对分子质量为36g•mol-1 | |
| D. | 根据题给条件无法计算混合气体在标准状况下的密度 |
16.下列实验操作正确的是( )
| A. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| C. | 先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 | |
| D. | 萃取,分液前不需对分液漏斗检漏 |
13.下列液体均处于25℃,有关叙述中,正确的是( )
| A. | 某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 | |
| C. | pH相同的氨水与盐酸等体积混合,所得溶液pH<7 | |
| D. | pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+)=c(CH3COO-) |
20.勒夏特列原理同样适用于电离平衡,请完成如表.
| CH3COOH?CH3COO-+H+ | |||
| 平衡移动方向 | c(H+) | 导电能力 | |
| (1)加水稀释 | |||
| (2)滴加浓盐酸 | |||
| (3)加NaOH | |||
| (4)加醋酸铵 | |||
| (5)升高温度 | |||
6.32.5gZn投入到VmL浓硫酸中,共热,恰好完全反应,则可以确定的数据是( )
| A. | 所得气体在标准状况下的体积 | B. | 所得气体的质量 | ||
| C. | 所得溶液的浓度 | D. | 原硫酸的浓度 |
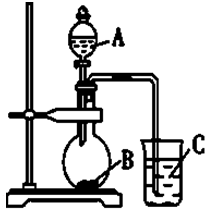
 .
.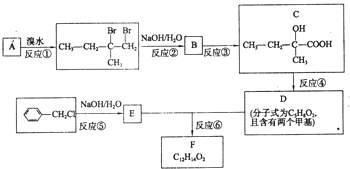 分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.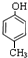 .
.