题目内容
16.已知C2H4(g)和C2H5OH(1)的标准燃烧热分别是a kJ•mol-1和b kJ•mol-1(其中a<0,b<0),请写出C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式C2H4(g)+H2O(l)=C2H5OH(l)△H=akJ/mol-bkJ/mol=(a-b)kJ/mol.分析 已知C2H4(g)和C2H5OH(l)的燃烧热分别是a kJ•mol-1和b kJ•mol-1(其中a<0,b<0),则①C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=akJ/mol,②C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=bkJ/mol,根据盖斯定律 ①-②可得C2H4(g)+H2O(l)=C2H5OH(l),反应热也进行相应的计算.
解答 解:已知C2H4(g)和C2H5OH(l)的燃烧热分别是a kJ•mol-1和b kJ•mol-1(其中a<0,b<0),则:
①C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=akJ/mol,
②C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=bkJ/mol,
根据盖斯定律 ①-②可得:C2H4(g)+H2O(l)=C2H5OH(l)△H=akJ/mol-bkJ/mol=(a-b)kJ/mol,
故答案为:C2H4(g)+H2O(l)=C2H5OH(l)△H=akJ/mol-bkJ/mol=(a-b)kJ/mol.
点评 本题考查了盖斯定律在热化学方程式书写中的应用,题目难度不大,明确盖斯定律的内容为解答关键,注意熟练掌握热化学方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
6. 二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.
二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.
(1)实验室采用如图装置制备S2Cl2:
有关物质的部分性质如表:
已知:S2Cl2遇水生成HCl、SO2、S;300℃以上完全分解,S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2SCl2
①图中B的作用是导气和冷凝;
②装置C与D之间应增加干燥装置,原因是2S2Cl2+2H2O=3S+SO2+4HCl(用化学方程式表示)
利用改进后的正确装置进行实验,请回答下列问题:
③加热A时温度过高,会使产率偏低的原因可能是S2Cl2300℃以上完全分解、温度过高会使硫气化(填写两点)
④装置C收集到的S2Cl2粗品中可能混有的杂质有SCl2、S,为提高S2Cl2的纯度,操作时除了应控制好温度,还应注意使氧气流速平缓.
(2)工业中常用电解饱和食盐水制取2氯气,粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室为提纯NaCl进行以下操作:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①为除去粗食盐中的Ca2+、Mg2+、Fe3+、SO42-离子,由上述提供的试剂中选出沉淀剂a所代表的试剂,按滴加顺序依次为BaCl2、NaOH、Na2CO3(NaOH溶液的加入顺序不影响)(只填化学式)
②上述操作中操作i为溶解,操作vi为过滤;
③简述测定氯化钠中含碳酸钠质量分数的实验方案:称取样品溶解,加过量CaCl2溶液,充分反应后过滤.将沉淀洗涤干燥后称量.
 二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.
二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.(1)实验室采用如图装置制备S2Cl2:
有关物质的部分性质如表:
| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 112.8 | -78 | -77 |
| 沸点/℃ | 444.6 | 59.6 | 137 |
①图中B的作用是导气和冷凝;
②装置C与D之间应增加干燥装置,原因是2S2Cl2+2H2O=3S+SO2+4HCl(用化学方程式表示)
利用改进后的正确装置进行实验,请回答下列问题:
③加热A时温度过高,会使产率偏低的原因可能是S2Cl2300℃以上完全分解、温度过高会使硫气化(填写两点)
④装置C收集到的S2Cl2粗品中可能混有的杂质有SCl2、S,为提高S2Cl2的纯度,操作时除了应控制好温度,还应注意使氧气流速平缓.
(2)工业中常用电解饱和食盐水制取2氯气,粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室为提纯NaCl进行以下操作:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①为除去粗食盐中的Ca2+、Mg2+、Fe3+、SO42-离子,由上述提供的试剂中选出沉淀剂a所代表的试剂,按滴加顺序依次为BaCl2、NaOH、Na2CO3(NaOH溶液的加入顺序不影响)(只填化学式)
②上述操作中操作i为溶解,操作vi为过滤;
③简述测定氯化钠中含碳酸钠质量分数的实验方案:称取样品溶解,加过量CaCl2溶液,充分反应后过滤.将沉淀洗涤干燥后称量.
7.下面的排序不正确的是( )
| A. | 晶体熔点由高到低:CI4>CBr4>CCl4>CF4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
4.下列说法正确的是( )
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| C. | 两种酸溶液充分反应后的体系不可能为中性 | |
| D. | 碳、氮形成的氢化物常温下都是气态 |
1.现有两种烯烃:CH2═CH2和CH2═CR2(R为烃基),它们的混合物进行聚合反应,产物中可能含有( )

| A. | ①⑤ | B. | ②④ | C. | ①③⑤ | D. | ①②③⑤ |
8.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 标况下,22.4LSO3含有σ键数目为3NA | |
| B. | 已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,则某容器内加入0.5 NA个N2(g)与足量的H2(g),充分反应后放出的热量为46 kJ | |
| C. | 标准状况下,22.4L氦气含有的原子数为2NA | |
| D. | 0.1mol HCN分子中含有的π键数目为0.2NA |
5.丁苯橡胶的结构简式如下: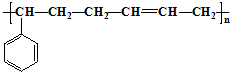 合成这种橡胶的单体应是( )
合成这种橡胶的单体应是( )
①苯乙烯 ②苯丙烯 ③2-丁烯 ④丙炔 ⑤1,3-丁二烯.
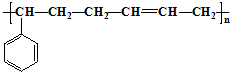 合成这种橡胶的单体应是( )
合成这种橡胶的单体应是( )①苯乙烯 ②苯丙烯 ③2-丁烯 ④丙炔 ⑤1,3-丁二烯.
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ①⑤ |
6.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,8gCH4含有5NA个电子 | |
| B. | 1mol Na与足量乙醇完全反应,失去2NA电子 | |
| C. | 1L 0.1mol•L-1的醋酸溶液中含有0.1NA个H+ | |
| D. | 标准状况下,22.4L苯含有约NA个C6H6分子 |