题目内容
4.下列说法正确的是( )| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| C. | 两种酸溶液充分反应后的体系不可能为中性 | |
| D. | 碳、氮形成的氢化物常温下都是气态 |
分析 A.化合物只含共价键,一定为共价化合物;
B.晶体中有阴离子,一定为离子晶体,但晶体有阳离子,可能为金属晶体;
C.氧化还原反应的发生有可能使得溶液的酸碱性发生变化;
D.碳、氮形成的氢化物苯、肼等为液体.
解答 解:A.化合物只含共价键,一定为共价化合物,则一定不是离子化合物,故A正确;
B.晶体中有阴离子,一定为离子晶体,但晶体有阳离子,可能为金属晶体,金属晶体中含自由电子带负电荷,故B错误;
C.由反应2H2S+H2SO3=3H2O+S↓可知,氢硫酸和亚硫酸溶液充分反应后的溶液体系为中性,所以两种酸溶液充分反应后的体系可能为中性,故C错误;
D.碳、氮形成的氢化物苯、肼等为液体,而甲烷、氨气常温下都是气态,故D错误;
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,注意晶体的构成微粒,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
14.将磷肥生产中形成的副产物石膏( CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都县有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图.
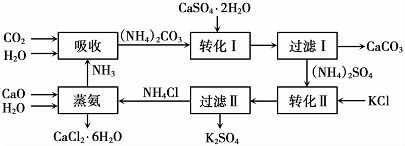
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式CaSO4+CO32-=CaCO3+SO42-
(3)过滤I操作所得固体中,除CaC03外还含有CaSO4(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤I操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-
(5)已知不同温度下K2SO4在l00g水中达到饱和时溶解的量如下表:
60℃时K2S04的饱和溶液591g冷却到0℃,可析出K2S04晶体54g.
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad.
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用(原子利用率高,没有有害物质排放到环境中).

(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式CaSO4+CO32-=CaCO3+SO42-
(3)过滤I操作所得固体中,除CaC03外还含有CaSO4(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤I操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-
(5)已知不同温度下K2SO4在l00g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解得量(g) | 7.4 | 11.1 | 18.2 |
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad.
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用(原子利用率高,没有有害物质排放到环境中).
12.下列有机物的命名正确的是( )
| A. |  2-甲基-3-丁烯 2-甲基-3-丁烯 | B. |  1,3,4-三甲苯 1,3,4-三甲苯 | C. |  2-乙基丙烷 2-乙基丙烷 | D. |  2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 |
19.合成导电高分子材料PPV的反应:

下列说法正确的是( )

下列说法正确的是( )
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 1mol 最多可以和5mol氢气发生加成反应 最多可以和5mol氢气发生加成反应 |
9.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收E kJ的能量,下列说法正确的是( )
| A. | 金刚石与石墨互为同分异构体 | |
| B. | 石墨转化为金刚石没有破坏化学键属于物理变化 | |
| C. | 等质量的石墨与金刚石完全燃烧,放出的能量相同 | |
| D. | 金刚石不如石墨稳定 |
14.下列变化需克服相同类型作用力的是( )
| A. | 食盐和蔗糖的熔化 | B. | 白磷和硫的熔化 | ||
| C. | 硅和C60的熔化 | D. | 氧化镁和金属镁的熔化 |
