题目内容
6. 二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.
二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.(1)实验室采用如图装置制备S2Cl2:
有关物质的部分性质如表:
| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 112.8 | -78 | -77 |
| 沸点/℃ | 444.6 | 59.6 | 137 |
①图中B的作用是导气和冷凝;
②装置C与D之间应增加干燥装置,原因是2S2Cl2+2H2O=3S+SO2+4HCl(用化学方程式表示)
利用改进后的正确装置进行实验,请回答下列问题:
③加热A时温度过高,会使产率偏低的原因可能是S2Cl2300℃以上完全分解、温度过高会使硫气化(填写两点)
④装置C收集到的S2Cl2粗品中可能混有的杂质有SCl2、S,为提高S2Cl2的纯度,操作时除了应控制好温度,还应注意使氧气流速平缓.
(2)工业中常用电解饱和食盐水制取2氯气,粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室为提纯NaCl进行以下操作:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①为除去粗食盐中的Ca2+、Mg2+、Fe3+、SO42-离子,由上述提供的试剂中选出沉淀剂a所代表的试剂,按滴加顺序依次为BaCl2、NaOH、Na2CO3(NaOH溶液的加入顺序不影响)(只填化学式)
②上述操作中操作i为溶解,操作vi为过滤;
③简述测定氯化钠中含碳酸钠质量分数的实验方案:称取样品溶解,加过量CaCl2溶液,充分反应后过滤.将沉淀洗涤干燥后称量.
分析 (1)干燥的氯气在装置A中与硫粉加热生成S2Cl2,蒸气通过弯曲试管B的冷凝在锥形瓶中得到固体S2Cl2,并利用D装置的NaOH溶液吸收尾气中的氯气,防止环境污染;实际操作中,为避免C中S2Cl2水解,需要在C和D之间添加一个干燥装置,防止水蒸汽进入C中;
①为使S2Cl2的蒸气能快速冷凝,使用弯曲的试管B;
②为避免C中S2Cl2水解,需要在C和D之间添加一个干燥装置;S2Cl2易水解生成S、SO2和HCl,结合原子守恒可写出此反应的化学方程式;
③装置A中与硫粉加热生成S2Cl2,S2Cl2在300℃以上受热易分解,另外硫粉受热易气化,故反应需要要控制适当温度,不易太高;
④S温度较高时易气化,另外S和Cl2加热时也可能生成SCl2;为提高S2Cl2的产品纯度,可通过控制反应温度及平衡的氯气气流达到目的;
(2)①把杂质转化为沉淀或气体除去,除钙离子用碳酸根,除镁离子用氢氧根,除硫酸根用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉;
②向粗盐中加水溶解得到混合溶液;操作vi是从饱和NaCl溶液里分离出晶体NaCl;
③欲测定氯化钠中含碳酸钠质量分数,可通过测定一定量固体配制的溶液与足量BaCl2溶液作用生成BaCO3沉淀的质量来达到实验目的.
解答 解:(1)干燥的氯气在装置A中与硫粉加热生成S2Cl2,蒸气通过弯曲试管B的冷凝在锥形瓶中得到固体S2Cl2,并利用D装置的NaOH溶液吸收尾气中的氯气,防止环境污染;实际操作中,为避免C中S2Cl2水解,需要在C和D之间添加一个干燥装置,防止水蒸汽进入C中;①弯曲的试管B达到导气和使S2Cl2冷凝的目的,故答案为:冷凝;
②在C和D之间添加一个干燥装置,可避免C中S2Cl2水解;S2Cl2水解生成S、SO2和HCl的反应的化学方程式为:2S2Cl2+2H2O=3S+SO2+4HCl;故答案为:干燥;2S2Cl2+2H2O=3S+SO2+4HCl;
③硫粉受热易气化且S2Cl2在300℃以上受热易分解,装置A中温度高于300℃以上会导致产率偏低,故答案为:S2Cl2300℃以上完全分解;温度过高会使硫气化;
④因硫的气化及S和Cl2可能反应生成SCl2;导致装置C中收集到的S2Cl2中含有S和SCl2,为提高S2Cl2的纯度,操作时除了应控制好温度,还应注意使氧气流速平缓,故答案为:S和SCl2;使氧气流速平缓;
(2)①除去粗盐中的可溶性杂质:Mg2+、Ca2+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序,故答案为:BaCl2,NaOH,Na2CO3(或NaOH,BaCl2,Na2CO3);②操作i的目的是加水溶解粗盐得到混合溶液;操作vi的目的是通过过滤从饱和NaCl溶液里分离出晶体NaCl,故答案为:溶解;过滤;
③通过称取样品溶解,加过量CaCl2溶液,充分反应后过滤,将沉淀洗涤干燥后称量操作可测定氯化钠中含碳酸钠质量分数,故答案为:称取样品溶解,加过量CaCl2溶液,充分反应后过滤.将沉淀洗涤干燥后称量.
点评 本题为物质的制备与混合物的分离提纯实验探究题,涉及操作要点分析、反应原理分析等,属基础考查,对学生分析问题、解决问题的能力要求高,整体难度适中.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案| ① | |||||||
| ② | ③ | ④ | |||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)表中序号元素中半径最大的常见离子是S2-.
(3)表中最高价氧化物对应水化物的碱性最强的物质的电子式为
 ,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.
,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.(4)元素非金属性强弱比较有很多方法,其中③和⑧的非金属性强弱的探究方案中不可行的是A(填序号)
A.比较两种氢化物的熔沸点高低 B.比较氢化物的稳定性
C.通过和铁反应,比较得电子能力 D.通过置换反应
(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,请写出该分子的电子式
 .
.(6)⑦与⑨两元素的单质反应生成1mol⑦的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
| A. | 常温下1L0.1mol•L-1NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略):A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D,若A是共价化合物,0.1molA分子中含有的质子数可能为NA | |
| D. | 用足量CO还原磁铁矿得到9mol铁时转移24mol电子 |
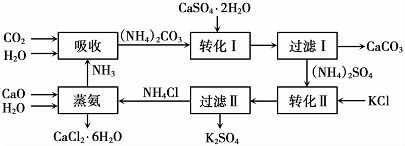
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式CaSO4+CO32-=CaCO3+SO42-
(3)过滤I操作所得固体中,除CaC03外还含有CaSO4(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤I操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-
(5)已知不同温度下K2SO4在l00g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解得量(g) | 7.4 | 11.1 | 18.2 |
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad.
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用(原子利用率高,没有有害物质排放到环境中).
①Al ②Al2O3 ③AlCl3 ④Na[Al(OH)4]⑤Al(OH)3 ⑥NaHCO3 ⑦(NH4)2CO3.
| A. | ①②⑤ | B. | ①②③④⑤ | C. | ①②⑤⑥⑦ | D. | 全部 |
| 装置 | 操作 | 现象 |
 | 添加试剂,检查装置气密性,点燃酒精灯 | i.C中气体颜色变浅 ii.稍后,C中出现白烟并逐渐增多 |
(2)B中干燥管中应选用的药品为c(填字母)
a.无水 CuSO4 b.硅胶 c.碱石灰
(3)现象ⅰ,C中发生的反应为:2NH3(g)+3Cl2(g)═N2(g)+6HCl(g)△H=-456kJ•mol-1
已知:

①NH3的电子式是
 .
.②断开1mol H-N键与断开1mol H-Cl键所需能量相差约为40KJkJ.
(4)现象ⅱ中产生白烟的化学方程式是HCl+NH3=NH4Cl
(5)某学生设计了如图装置以完成Cl2和NH3的反应.若该装置能实现设计目标,则

①石墨b电极上发生的是还原反应(填“氧化”或“还原”)
②写出石墨a电极的电极反应式:2NH3+6OH--6e-=N2+6H2O.
 下列有关叙述正确的是( )
下列有关叙述正确的是( )| A. | 它有两种同分异构体 | B. | 它是平面分子 | ||
| C. | 它只有一种结构 | D. | 它有4种同分异构体 |