题目内容
7.下面的排序不正确的是( )| A. | 晶体熔点由高到低:CI4>CBr4>CCl4>CF4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
分析 A.分子晶体的相对分子质量越大,熔沸点越大;
B.键长越短,共价键越强,硬度越大;
C.金属离子的电荷越大、半径越小,其熔点越大;
D.离子半径越小、离子键越强,则晶格能越大.
解答 解:A.分子晶体的相对分子质量越大,熔沸点越大,则晶体熔点由高到低:CI4>CBr4>CCl4>CF4,故A正确;
B.键长越短,共价键越强,硬度越大,键长C-C<C-Si<Si-Si,则硬度由大到小:金刚石>碳化硅>晶体硅,故B正确;
C.金属离子的电荷越大、半径越小,其熔点越大,则熔点由高到低为:Al>Mg>Na,故C错误;
D.离子半径越小、离子键越强,则晶格能越大,F、Cl、Br、I的离子半径在增大,则晶格能由大到小:NaF>NaCl>NaBr>NaI,故D正确;
故选C.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
相关题目
3.设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 常温下1L0.1mol•L-1NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略):A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D,若A是共价化合物,0.1molA分子中含有的质子数可能为NA | |
| D. | 用足量CO还原磁铁矿得到9mol铁时转移24mol电子 |
18.氟利昂12是甲烷的氯、氟卤代物,结构式为 下列有关叙述正确的是( )
下列有关叙述正确的是( )
 下列有关叙述正确的是( )
下列有关叙述正确的是( )| A. | 它有两种同分异构体 | B. | 它是平面分子 | ||
| C. | 它只有一种结构 | D. | 它有4种同分异构体 |
12.下列有机物的命名正确的是( )
| A. |  2-甲基-3-丁烯 2-甲基-3-丁烯 | B. |  1,3,4-三甲苯 1,3,4-三甲苯 | C. |  2-乙基丙烷 2-乙基丙烷 | D. |  2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 |
19.合成导电高分子材料PPV的反应:

下列说法正确的是( )

下列说法正确的是( )
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 1mol 最多可以和5mol氢气发生加成反应 最多可以和5mol氢气发生加成反应 |
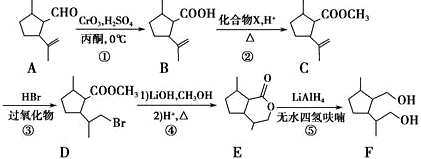
 .
.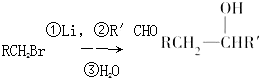
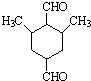
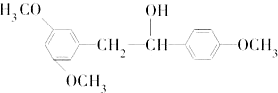 是合成抗癌药物白黎芦醇的中间体,请写出以
是合成抗癌药物白黎芦醇的中间体,请写出以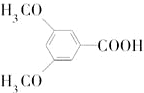 、
、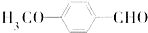 和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: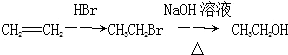

 +CO2+H2O→NaHCO3+
+CO2+H2O→NaHCO3+ .
.