题目内容
10.下列对应化学反应的离子方程式正确的是( )| A. | KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向碳酸氢铵溶液中加过量氢氧化钠溶液并加热:NH4++OH-═NH3↑+H2O | |
| C. | Na[Al(OH)4]-溶液中通入过量CO2制Al(OH)3:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
分析 A.酸性条件下,反应产物中不会存在氢氧根离子;
B.碳酸氢根离子也参与反应,漏掉了碳酸氢根离子与氢氧根离子的反应;
C.二氧化碳过量,反应生成氢氧化铝沉淀和碳酸氢根离子;
D.稀硝酸具有强氧化性,能够氧化亚硫酸根离子.
解答 解:A.KIO3与KI在酸性溶液中反应生成碘单质,正确的离子方程式为:5I-+IO3-+6H+═3I2+3H2O,故A错误;
B.碳酸氢铵溶液中加过量氢氧化钠溶液并加热,反应生成碳酸钠、氨气和水,正确的离子方程式为:2OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O,故B错误;
C.Na[Al(OH)4]-溶液中通入过量CO2制Al(OH)3,反应的离子方程式为:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3-,故C正确;
D.向稀HNO3中滴加Na2SO3溶液,二者发生氧化还原反应,正确的离子方程式为:3SO32-+2NO3-+2H+═3SO42-+2NO↑+H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等,试题培养了学生的灵活应用能力.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
18.铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2•2H2O )的流程如下.
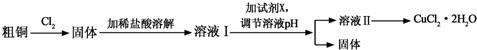
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见表:
请回答下列问题:
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向0.1mol•L-1的CuCl2溶液中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
若KSP[CuS]=1.2×10-36,则生成沉淀时需要S2-的浓度为1.2×10-35mol•L-1.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液,达到滴定终点时,溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).
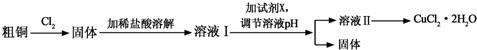
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向0.1mol•L-1的CuCl2溶液中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
若KSP[CuS]=1.2×10-36,则生成沉淀时需要S2-的浓度为1.2×10-35mol•L-1.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液,达到滴定终点时,溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).
5.铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2•2H2O )的流程如下.

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)室温下,将NaOH溶液逐滴加入到浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中,先生成的沉淀是Cu(OH)2.(室温时KSP[Mg(OH)2]=1.8×10-11,KSP[Cu(OH)2]=2.2×10-20)
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不与发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉,达到滴定终点时的溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)室温下,将NaOH溶液逐滴加入到浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中,先生成的沉淀是Cu(OH)2.(室温时KSP[Mg(OH)2]=1.8×10-11,KSP[Cu(OH)2]=2.2×10-20)
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不与发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉,达到滴定终点时的溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).
19.下列结论正确的是( )
| A. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 | |
| B. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,则金刚石比石墨稳定 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则含20 g NaOH的稀溶液与稀醋酸恰好完全反应,放出的热量为28.7 kJ | |
| D. | 2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则碳的燃烧热等于110.5 kJ•mol-1 |
20.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是( )

| A. | 装置甲中铜片表面产生气泡 | |
| B. | 装置甲溶液中SO42ˉ向铜片做定向移动 | |
| C. | 装置乙中电子从铜片经导线流向锌片 | |
| D. | 装置乙中正极的电极反应式:2H++2eˉ═H2↑ |

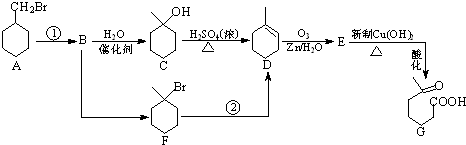
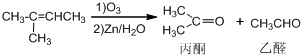
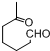 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$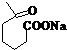 +Cu2O↓+3H2O;
+Cu2O↓+3H2O; 物质D与呋喃(
物质D与呋喃(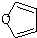 )也可以发生“Diels-Alder反应”,该化学反应方程式为
)也可以发生“Diels-Alder反应”,该化学反应方程式为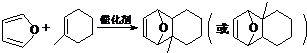 .
.