题目内容
6.铁、铝在生产生活中有广泛的应用.完成下列填空:(1)铝用作电线是利用了铝的导电性;铁用作炊具是利用了铁的导热性.
(2)常温下由于浓硫酸能使铁钝化,因此浓硫酸可用铁槽车运输.
(3)氢氧化铝既能跟盐酸反应又能跟氢氧化钠溶液反应,写出氢氧化铝和氢氧化钠反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
分析 (1)铝用作电线与导电性有关,铁用作炊具与导热性有关;
(2)常温下Fe遇浓硫酸发生钝化,生成致密的氧化膜阻止反应的进一步发生;
(3)氢氧化铝和氢氧化钠反应生成偏铝酸钠和水.
解答 解:(1)铝用作电线是利用了铝的导电性;铁用作炊具是利用了铁的导热性,故答案为:导电;导热;
(2)常温下由于浓硫酸能使铁钝化,因此浓硫酸可用铁槽车运输,故答案为:钝化;
(3)氢氧化铝和氢氧化钠反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查Al及其化合物的性质,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列热化学方程式中的△H表示可燃物燃烧热的是( )
| A. | 2H2(g)+O2(g)=2H2O(l)△H1 | B. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H2 | ||
| C. | HCl(aq)+NaOH(aq)=NaCl(aq)+H2O( l )△H3 | D. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O( l )△H4 |
17.“珍爱生命,拒绝毒品”.下列物质不属于毒品的是( )
| A. | 冰毒 | B. | 盘尼西林 | C. | 海洛因 | D. | 吗啡 |
14.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在16g18O2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L空气含有NA个单质分子 | |
| C. | 1 mol•L-1的NaClO 溶液中含有ClO-的数目少于NA个 | |
| D. | 12gMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA |
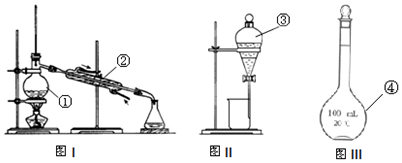
11.下列实验操作正确的是( )
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,倒置,观察是否漏水 | |
| C. | 在分液漏斗中分离两种液体时,要先从下端放出密度较大的液体,关闭活塞,取另一只烧杯后打开活塞再放出密度较小的液体 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
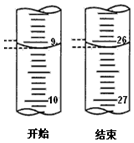 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
 CO↑+H2O.
CO↑+H2O.