题目内容
1.下列关系式中,正确的是( )| A. | 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,将0.1 mol•L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的100倍 |
分析 A.等浓度等体积的CH3COOH和CH3COONa溶液混合,CH3COOH电离程度大于CH3COO-水解程度;
B.常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液等体积混合,二者物质的量相等,且都是一元的,二者恰好反应生成NaA和水,要根据HA的强弱判断溶液中离子浓度大小;
C.任何电解质溶液都存在质子守恒,根据质子守恒判断;
D.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$.c(H+)=Ka,温度不变,醋酸电离平衡常数不变.
解答 解:A.等浓度等体积的CH3COOH和CH3COONa溶液混合,CH3COOH电离程度大于CH3COO-水解程度,结合物料守恒得c(CH3COO-)>c(Na+)>c(CH3COOH),溶液中存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),所以c(CH3COO-)+c(OH-)>c(H+)+c(CH3COOH),故A错误;
B.常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液等体积混合,二者物质的量相等,且都是一元的,二者恰好反应生成NaA和水,如果HA是强酸,则溶液呈中性,c(OH-)=c(H+);如果HA是弱酸,NaA是强碱弱酸盐,其水溶液呈碱性,则c(OH-)>c(H+),故B错误;
C.任何电解质溶液都存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HS-)+2c(H2S),故C错误;
D.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$.c(H+)=Ka,温度不变,醋酸电离平衡常数不变,氢离子浓度降为原来的$\frac{1}{100}$,所以溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的100倍,故D正确;
故选D.
点评 本题考查离子浓度大小比较、弱电解质的电离,为高频考点,明确溶液中溶质及其性质结合电解质溶液酸碱性是解本题关键,易错选项是D,题目难度不大.

| A. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm互为同位素 | |
| B. | 氯气能使潮湿的蓝布条变为白色,说明氯气有漂白性 | |
| C. | 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L | |
| D. | 焰色反应发生的是物理变化 |
| A. | ZnCl2溶液 | B. | NaCl溶液 | C. | CaCl2溶液 | D. | FeCl3溶液 |
| A. | 高纯度的单晶硅用于制造光导纤维 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 乙酸乙酯在碱性条件下水解称为皂化反应 | |
| D. | 可溶性铜盐有毒,在生命体中铜是一种不可缺少的微量元素 |
| A. | 合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| C. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)能自发进行,则该反应的△H>0 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g);△H1,2C(s)+O2(g)═2CO(g);△H2.则△H1<△H2 |
| A. | 若增大压强,平衡向正方向移动,平衡常数变大 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015mol/L | |
| C. | 达到平衡时X浓度为0.04 mol/L | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
| A. | 2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| B. | 2Fe2++4I-+4Br-+5Cl2═2Fe3++2I2+2Br2+10Cl- | |
| C. | 2Fe2++2I-+2Br-+3Cl2═2Fe3++I2+Br2+6Cl- | |
| D. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O;
+3H2O;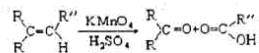

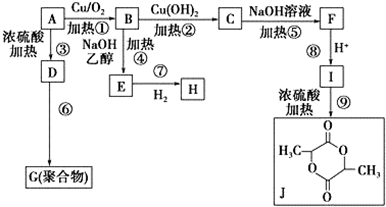
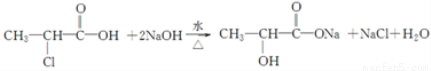 .
.