题目内容
4.某火星车取回一种岩石样品为铁的氧化物(仅含铁和氧).取一块该样品恰好完全溶于200mL3.5mol•L-1硫酸中,向溶液中通入1120mL氯气(标准状况)恰好完全反应,向反应后的溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,无沉淀产生.根据上述数据,推知样品的化学式为( )| A. | Fe3O4 | B. | Fe4O5 | C. | Fe5O7 | D. | Fe7O10 |
分析 铁的氧化物与硫酸反应生成盐和水,n(O)=n(H2O)=n(H2SO4)=0.2L×3.5mol/L=0.7mol,向溶液中通入1120mL氯气(标准状况)恰好完全反应,向反应后的溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,无沉淀产生,可知反应后不存在亚铁离子,由电子守恒可知n(Fe2+),最后利用电荷守恒计算n(Fe3+),以此确定化学式.
解答 解:铁的氧化物与硫酸反应生成盐和水,n(O)=n(H2O)=n(H2SO4)=0.2L×3.5mol/L=0.7mol,向溶液中通入1120mL氯气(标准状况)恰好完全反应,向反应后的溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,无沉淀产生,可知反应后不存在亚铁离子,由电子守恒可知n(Fe2+)=$\frac{\frac{1.12L}{22.4L/mol}×2×(1-0)}{(3-2)}$=0.1mol,盐溶液不显电性,由电荷守恒可知n(Fe3+)×3+n(Fe2+)×2=n(SO42-)×2,解得n(Fe3+)=$\frac{0.7mol×2-0.1mol×2}{3}$=0.4mol,
综上所述,n(Fe):n(O)=(0.1mol+0.4mol):0.7mol=5:7,即铁的氧化物的化学式为Fe5O7,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子守恒、电荷守恒及原子守恒等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
17.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下,相同浓度的盐酸与氨水的混合溶液的pH=7,消耗盐酸的体积大 | |
| B. | 将pH=5的醋酸溶液稀释1000倍,溶液的pH=8 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
15.常温下,向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )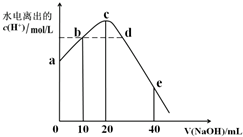

| A. | 从a到c,醋酸的电离始终受到促进 | |
| B. | a、d对应的纵坐标数值分别是:>10-12、>10-7 | |
| C. | b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点 |
19.下列离子方程式正确的是( )
| A. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 向AlCl3溶液中投入过量Na:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| C. | 向FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4 |
 香叶醇是合成玫瑰精油的主要原料,其结构简式如下:
香叶醇是合成玫瑰精油的主要原料,其结构简式如下: