题目内容
17.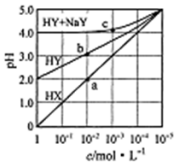 常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )| A. | HX是强酸,溶液每稀释10倍,pH始终增大1 | |
| B. | 常温下HY的电离常数为1.0×10-4 | |
| C. | 溶液中水的电离程度:a点大于b点 | |
| D. | c 点溶液中:c(Na+)>c(Y-)>c(HY)c(H+)>c(OH-) |
分析 A.1.0mol/L的HX溶液PH=1说明为强酸,加水稀释溶液PH最终接近7;
B.1.0mol/LHY溶液PH=2,结合定量平衡常数K=$\frac{c({H}^{+})c({Y}^{-})}{c(HY)}$;
C.HX为强酸,HY为弱酸,加水稀释相同倍数,HX溶液中氢离子浓度小于HY;
D.HY和 NaY的混合溶液,溶液PH=4,说明溶液显酸性,HY电离大于Y-离子水解,加水稀释后溶液仍显酸性,据此判断溶液中离子浓度大小.
解答 解:A.图象中1.0mol/L的HX溶液PH=1说明为强酸,加水稀释溶液PH最终接近7,溶液每稀释10倍,pH增大不一定是1,故A错误;
B.1.0mol/LHY溶液PH=2,c(H)=10-2mol/L,结合定量平衡常数K=$\frac{c({H}^{+})c({Y}^{-})}{c(HY)}$=$\frac{1{0}^{-2}×1{0}^{-2}}{1-0.01}$≈1×10-4,故B正确;
C.HX为强酸,HY为弱酸,加水稀释相同倍数,a点HX溶液中氢离子浓度大于b点HY,溶液中水的电离程度:a点小于b点,故C错误;
D.HY和NaY的混合溶液,溶液PH=4,说明溶液显酸性,HY电离大于Y-离子水解,加水稀释后溶液仍显酸性,据此判断溶液中离子浓度大小,c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查了弱电解质电离平衡、电离平衡影响因素分析、电离平衡常数计算、对水电离平衡影响判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
7.下列有关说法正确的是( )
| A. | 明矾既可用作净水剂,也可用作消毒剂 | |
| B. | 小苏打、氢氧化铝都可用于治疗胃酸过多 | |
| C. | 煤的干馏、石油的分馏都属于化学变化 | |
| D. | 已知PM2.5是指大气中直径小于或等于2.5微米(1微米=1000纳米)的颗粒物,则PM2.5在空气中能形成胶体 |
12.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y 和Z最外层电子数之和与W的最外层电子数相同.25℃时0.1mol/LX和W形成化合物的水溶液pH为1.下列说法正确的是( )
| A. | Y和其它四种元素均可形成至少两种化合物(两种元素组成) | |
| B. | 原子半径由大到小排列的顺序是:R>W>Z>Y>X | |
| C. | 在Z、Y形成的两种离子化合物中阴阳离子的个数比均为2:1 | |
| D. | Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
2.下列反应能用离子方程式CO32-+2H+→CO2↑+H2O表示的是( )
| A. | 石灰石与足量盐酸反应 | B. | 碳酸钠与足量盐酸反应 | ||
| C. | 碳酸钠与足量醋酸反应 | D. | 碳酸钡与足量硝酸反应 |
9.下列物质既含有共价键又含有离子键的是( )
| A. | NaOH | B. | Cl2 | C. | HCl | D. | NaCl |
6.对如图两种有机物的描述错误的是( )


| A. | 互为同分异构体 | B. | 均能与钠反应 | ||
| C. | 均能发生加成反应 | D. | 可用银氨溶液鉴别 |
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 136g熔融的KHSO4中含有2NA个阳离子 | |
| B. | 40gH218O与40gD2O所含的中子数均为20NA | |
| C. | 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA | |
| D. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA |
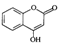 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成.
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成.
 .
. .
.