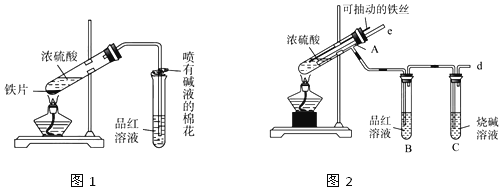
题目内容
5.(1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H=-272.0kJ•mol-1
2Al(s)+$\frac{3}{2}$O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
Al和FeO发生铝热反应的热化学方程式是3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ.mol-1.
(2)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).
①已知K1000℃<K1200℃,则该反应是吸热反应(填“吸热”或“放热”).
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性S2-+H2O?HS-+OH-.
(3)全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为
VO2++2H++V2+$?_{充电}^{放电}$V3++VO2++H2O.则充电时阳极反应式为VO2++H2O-e-═VO2++2H+.
用此电池电解1L 1mol•L-1的CuSO4溶液,当转移0.1mol 电子时,溶液的pH=1(不考虑溶液体积的变化).
(4)常温下,如果取0.1mol.L-1HA溶液与0.1mol.L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)>(填<、>、=)0.1mol•L-1NaOH溶液中水电离出的c(H+).
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH>7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为c>a>b>d.(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.
分析 (1)①Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H=-272.0kJ•mol-1
②2Al(s)+$\frac{3}{2}$O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
由盖斯定律可知,②-①×3得到3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s);
(2)①K1000℃<K1200℃,可知升高温度平衡正向移动;
②Na2S水解显碱性;
(3)充电时阳极发生氧化反应,失去电子;电解1L 1mol•L-1的CuSO4溶液,发生2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑~4e-,当转移0.1mol 电子时,生成硫酸为0.05mol;
(4)①等体积等浓度混合生成NaA,混合液的pH=8,可知水解显碱性,水解促进水的电离,NaOH抑制水的电离;
②HA溶液加到Na2CO3溶液中有气体放出,则HA酸性大于碳酸,(NH4)2CO3溶液水解显碱性;酸性越强pH越小,以此来解答.
解答 解:(1)①Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H=-272.0kJ•mol-1
②2Al(s)+$\frac{3}{2}$O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
由盖斯定律可知,②-①×3得到3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ.mol-1,
则Al和FeO发生铝热反应的热化学方程式是3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ.mol-1,
故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ.mol-1;
(2)①K1000℃<K1200℃,可知升高温度平衡正向移动,则正反应为吸热反应,故答案为:吸热;
②Na2S水解显碱性,发生离子反应为S2-+H2O?HS-+OH-,故答案为:S2-+H2O?HS-+OH-;
(3)充电时阳极发生氧化反应,失去电子,则阳极反应为VO2++H2O-e-═VO2++2H+;电解1L 1mol•L-1的CuSO4溶液,发生2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑~4e-,当转移0.1mol 电子时,生成硫酸为0.05mol,氢离子浓度为$\frac{0.05mol×2}{1L}$=0.1mol/L,pH=1,
故答案为:VO2++H2O-e-═VO2++2H+;1;
(4)①等体积等浓度混合生成NaA,混合液的pH=8,可知水解显碱性,水解促进水的电离,NaOH抑制水的电离,则混合溶液中水电离出的c(H+)>0.1mol•L-1NaOH溶液中水电离出的c(H+),
故答案为:>;
②HA溶液加到Na2CO3溶液中有气体放出,则HA酸性大于碳酸,(NH4)2CO3溶液水解显碱性,(NH4)2CO3溶液的pH>7;酸性越强pH越小,NH4HCO3、(NH4)2CO3的pH>7,但碳酸根离子水解程度大,NH4A的pH=7,NH4Cl的pH<7,pH由大到小的顺序为c>a>b>d,
故答案为:>;c>a>b>d.
点评 本题考查较综合,涉及反应热与焓变、平衡常数与平衡移动、电化学、酸碱混合等,为高频考点,把握盖斯定律应用、温度对K的影响、电极反应、盐类水解为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

| A. | 1 mol甲基(CH3-)所含的电子数分别为10NA | |
| B. | 标准状况下,22.4 L四氯化碳中含有C-Cl键的数目为4NA | |
| C. | 常温常压下,1 mol分子式为C2H6O的有机物中,含有C-O键的数目为NA | |
| D. | 46g 由NO2和N2O4组成的混合气体中,含有的原子总数为3NA |
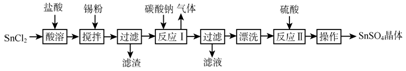
 手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )
手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )| A. | H2A在水中的电离方程式是:H2A═2H++A2- | |
| B. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 | |
| C. | 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 当V(NaOH)=30mL时,则有:c(H+)+c(Na+)═c(A2-)+c(OH-)+c(HA-) |
[探究一]:SO2能否被BaCl2溶液吸收.
甲.乙两同学分别设计如图装置甲和装置乙进行探究
甲、乙两同学实验时观察到各仪器中的现象如下:
| A | B | C | D | |
| 装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
| 装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |
(1)甲同学经过后续实验确证了B中白色沉淀是BaSO4.甲同学的后续实验操作是打开B试管的胶塞,向其中滴加稀盐酸,若白色沉淀不消失,证明白色沉淀是BaSO4

(2)乙同学分析装置甲中产生BaSO4的可能原因有:
①A中产生的白雾是硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀.
②2SO2+O2+2H2O+2Ba2+=2BaSO4+4H+(用离子方程式表示).
(3)装置乙中B中所盛试剂是饱和NaHSO3溶液;乙同学在滴加浓硫酸之前的操作是打开弹簧夹向A中通往一段时间的N2,然后关闭弹簧夹
(4)通过上述实验,得出的结论是SO2不能被BaCl2溶液吸收
[探究二]:SO2与FeCl3溶液的反应
查阅资料:①Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+;②生成Fe(HSO3)2+离子的反应为可逆反应.实验步骤为:
| 步骤I | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤II | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(5)当SO2通入到FeCl3(未用盐酸酸化)溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
则溶液由棕黄色变成红棕色的原因是二氧化硫溶于水SO2+H2O?HSO3-+H+,Fe3++HSO3-?Fe(HSO3)2+;写出溶液由红棕色变为浅绿色时发生反应的离子方程式Fe3++Fe(HSO3)2++H2O=2Fe2++SO42-+3H+
(6)通过实验可知加热和增加FeCl3溶液的酸度可缩短浅绿色出现的时间.
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 苯乙烯分子中含有4个碳碳双键 | B. | 苯乙烯分子式为C8H10 | ||
| C. | 乙苯有三种同分异构体 | D. | 乙苯能发生取代、加成和氧化反应 |
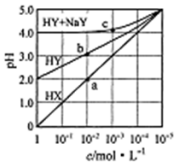 常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )| A. | HX是强酸,溶液每稀释10倍,pH始终增大1 | |
| B. | 常温下HY的电离常数为1.0×10-4 | |
| C. | 溶液中水的电离程度:a点大于b点 | |
| D. | c 点溶液中:c(Na+)>c(Y-)>c(HY)c(H+)>c(OH-) |
 与氢气加成产物的名称是( )
与氢气加成产物的名称是( )| A. | 4-甲基己烷 | B. | 2-乙基戊烷 | C. | 1,3-二甲基戊烷 | D. | 3-甲基己烷 |