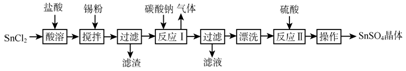
题目内容
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 136g熔融的KHSO4中含有2NA个阳离子 | |
| B. | 40gH218O与40gD2O所含的中子数均为20NA | |
| C. | 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA | |
| D. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA |
分析 A、求出硫酸氢钾的物质的量,然后根据硫酸氢钾在熔融状态下只能电离为钾离子和硫酸氢根离子;
B、H218O与D2O的摩尔质量均为20g/mol,且均含10个中子;
C、铁和稀硫酸反应变为+2价,和稀硝酸反应变为+3价;
D、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
解答 解:A、136g硫酸氢钾的物质的量为1mol,而硫酸氢钾在熔融状态下只能电离为钾离子和硫酸氢根离子,故1mol硫酸氢钾在熔融状态下只能电离出NA个阳离子,故A错误;
B、H218O与D2O的摩尔质量均为20g/mol,故40gH218O与40gD2O的物质的量均为2mol,且两者均含10个中子,故2molH218O与D2O中均含20NA个中子,故B正确;
C、铁和稀硫酸反应变为+2价,和稀硝酸反应变为+3价,故1mol铁和稀硫酸和稀硝酸反应后转移的电子数不同,故C错误;
D、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,故反应后分子总数小于NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
17.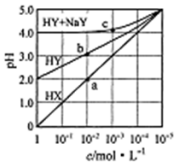 常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
 常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )| A. | HX是强酸,溶液每稀释10倍,pH始终增大1 | |
| B. | 常温下HY的电离常数为1.0×10-4 | |
| C. | 溶液中水的电离程度:a点大于b点 | |
| D. | c 点溶液中:c(Na+)>c(Y-)>c(HY)c(H+)>c(OH-) |
18.在复杂体系中,确定化学反应先后顺序有利于解决问题.已知氧化性Fe3+>Cu2+>Fe2+.若在氯化铁溶液蚀刻铜印刷电路板后所得的溶液里加入过量锌片.下列说法正确的是( )
| A. | Fe3+首先反应,转化为Fe | B. | 反应开始时c(Fe2+)增大,然后又减小 | ||
| C. | Fe2+首先反应,转化为Fe | D. | 存在反应Fe+Cu2+→Fe2++Cu |
12.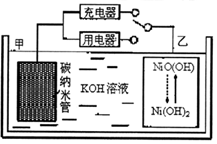 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 电池总反应为H2+2NiOOH$?_{放电}^{充电}$2Ni(OH)2 | |
| B. | 放电时,甲电极为负极,OH-移向乙电极 | |
| C. | 放电时,乙电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 充电时,电池的碳电极与直流电源的正极相连 |
19.新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2.请设计实验证明有O2生成将盛满氯水的无色塑料瓶倒置在水槽中,光照一段时间后,有无色气体生成,将瓶子倒转过来,用带火星的木条插入瓶口检验气体,若木条复燃,证明HClO分解生成的气体为氧气.
(2)氯气能使湿润的红色布条褪色.对于使红色布条褪色的物质,同学们的看法不
一致,认为氯水中存在的几种粒子都有可能.请你设计实验,得出正确结论.
(3)已知室温下,H2CO3?HCO3-+H+ Ka1(H2CO3)=4.45×10-7
HCO3-?CO32-+H+Ka2(H2CO3)=5.61×10-11
HClO?H++ClO-Ka(HClO)=2.95×10-8
HCN?H++CN-Ka(HCN)=5×10-10
①少量CO2通入NaCN溶液中的化学方程式CO2+H2O+NaCN=HCN+NaHCO3少量的氯气通入到过量的碳酸钠溶液中的离子方程式Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-;
②室温下等浓度的a.NaCN溶液 b.NaClO溶液 c.NaHCO3溶液的pH从大到小的顺序是a>b>c;
③室温下0.05mol/L NaCN溶液的pH为11.
(1)HClO不稳定,见光易分解生成HCl和O2.请设计实验证明有O2生成将盛满氯水的无色塑料瓶倒置在水槽中,光照一段时间后,有无色气体生成,将瓶子倒转过来,用带火星的木条插入瓶口检验气体,若木条复燃,证明HClO分解生成的气体为氧气.
(2)氯气能使湿润的红色布条褪色.对于使红色布条褪色的物质,同学们的看法不
一致,认为氯水中存在的几种粒子都有可能.请你设计实验,得出正确结论.
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①氯气使布条褪色 ②盐酸使布条褪色 ③次氯酸使布条褪色 ④H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:把红色布条伸入稀盐酸中,红色布条不褪色 实验③:把红色布条伸入氯水中,红色布条褪色 实验④:把红色布条放在水里,布条不褪色. | 结论: 次氯酸使布条褪色 |
HCO3-?CO32-+H+Ka2(H2CO3)=5.61×10-11
HClO?H++ClO-Ka(HClO)=2.95×10-8
HCN?H++CN-Ka(HCN)=5×10-10
①少量CO2通入NaCN溶液中的化学方程式CO2+H2O+NaCN=HCN+NaHCO3少量的氯气通入到过量的碳酸钠溶液中的离子方程式Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-;
②室温下等浓度的a.NaCN溶液 b.NaClO溶液 c.NaHCO3溶液的pH从大到小的顺序是a>b>c;
③室温下0.05mol/L NaCN溶液的pH为11.
16.下列化学变化属于取代反应的是( )
| A. | 甲烷在空气中完全燃烧 | |
| B. | 在镍做催化剂的条件下,苯与氢气反应 | |
| C. | 乙烯通入溴水中 | |
| D. | 乙醇与乙酸制备乙酸乙酯 |
17.下列反应的离子方程式书写正确的是( )
| A. | 铁和稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 惰性电极电解熔融氯化钠:2Clˉ+2H2O$\frac{\underline{\;电解\;}}{\;}$2OHˉ+H2↑+Cl2↑ | |
| C. | 等体积等物质的度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO32-+NH4+═BaCO3↓+NH3•H2O+H2O | |
| D. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ |