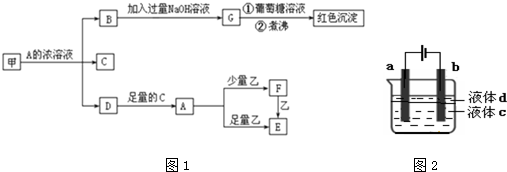
题目内容
制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程Ⅰ除去的离子是 .
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
①检测Fe3+是否除尽的方法是 .
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因 .
③除去Mg2+的离子方程式是 .
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是 .
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如图:

①过程Ⅳ除去的离子是 .
②盐水b中含有SO42-.Na2S2O3将IO3-还原为I2的离子方程式是 .
③过程Ⅵ中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释: .
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程Ⅰ除去的离子是
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因
③除去Mg2+的离子方程式是
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如图:

①过程Ⅳ除去的离子是
②盐水b中含有SO42-.Na2S2O3将IO3-还原为I2的离子方程式是
③过程Ⅵ中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:
考点:粗盐提纯,难溶电解质的溶解平衡及沉淀转化的本质,电解原理,物质的分离、提纯和除杂
专题:实验题
分析:(1)根据氯化钡能够与硫酸根离子反应生成硫酸钡进行解答;
(2)①根据检验铁离子的方法进行分析Fe3+是否除尽的方法;
②根据表中数据分析BaSO4与CaSO4的溶解度大小,溶解度越小,沉淀越完全;
③镁离子能够与碳酸根离子反应生成Mg2(OH)2CO3沉淀,从而除去镁离子杂质,据此写出反应的离子方程式;
④根据BaCO3、CaCO3、Mg2(OH)2CO3 的溶解度进行分析;
(3)①次氯酸根离子具有强氧化性,能够氧化铵根离子和碘离子;
②Na2S2O3具有还原性,能够与碘酸根离子发生氧化还原反应,同时被氧化成硫酸根离子,据此写出反应的离子方程式;
③根据电解原理及水的电离平衡H2O?H++OH-进行分析在电解槽的阴极区生成NaOH原理.
(2)①根据检验铁离子的方法进行分析Fe3+是否除尽的方法;
②根据表中数据分析BaSO4与CaSO4的溶解度大小,溶解度越小,沉淀越完全;
③镁离子能够与碳酸根离子反应生成Mg2(OH)2CO3沉淀,从而除去镁离子杂质,据此写出反应的离子方程式;
④根据BaCO3、CaCO3、Mg2(OH)2CO3 的溶解度进行分析;
(3)①次氯酸根离子具有强氧化性,能够氧化铵根离子和碘离子;
②Na2S2O3具有还原性,能够与碘酸根离子发生氧化还原反应,同时被氧化成硫酸根离子,据此写出反应的离子方程式;
③根据电解原理及水的电离平衡H2O?H++OH-进行分析在电解槽的阴极区生成NaOH原理.
解答:
解:(1)向粗盐水中加入过量BaCl2溶液,硫酸根离子与氯化钡溶液反应生成硫酸钡沉淀,通过过滤除去硫酸钡,从而除去杂质SO42-,
故答案为:SO42-;
(2)①检测Fe3+是否除尽的方法为:取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽,
故答案为:取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽;
②硫酸钡的溶度积为2.4×10-4,硫酸钙的溶度积为2.6×10-2,显然硫酸钙的溶度积大于硫酸钡,即BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完,
故答案为:BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完;
③镁离子能够与碳酸根离子反应生成难溶物Mg2(OH)2CO3,反应的离子方程式为:2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑,
故答案为:2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑;
④根据步骤数据可知,在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全,
故答案为:在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全;
(3)①过程Ⅳ加入次氯酸钠,次氯酸根离子能够氧化NH4+、I-,从而除去杂质NH4+、I-,
故答案为:NH4+、I-;
②盐水b中含有SO42-,Na2S2O3将IO3-还原为I2,Na2S2O3被氧化成硫酸根离子,反应的离子方程式为:5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O,
故答案为:5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O;
③电解过程中,H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成,
故答案为:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
故答案为:SO42-;
(2)①检测Fe3+是否除尽的方法为:取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽,
故答案为:取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽;
②硫酸钡的溶度积为2.4×10-4,硫酸钙的溶度积为2.6×10-2,显然硫酸钙的溶度积大于硫酸钡,即BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完,
故答案为:BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完;
③镁离子能够与碳酸根离子反应生成难溶物Mg2(OH)2CO3,反应的离子方程式为:2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑,
故答案为:2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑;
④根据步骤数据可知,在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全,
故答案为:在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全;
(3)①过程Ⅳ加入次氯酸钠,次氯酸根离子能够氧化NH4+、I-,从而除去杂质NH4+、I-,
故答案为:NH4+、I-;
②盐水b中含有SO42-,Na2S2O3将IO3-还原为I2,Na2S2O3被氧化成硫酸根离子,反应的离子方程式为:5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O,
故答案为:5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O;
③电解过程中,H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成,
故答案为:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
点评:本题考查了粗盐的提纯、难溶电解质的沉淀平衡及转化、电解原理、离子方程式的书写等知识,题目难度中等,试题涉及的题量较大,知识点较多,注意掌握粗盐的提纯方法、物质的分离与提纯原则,明确电解原理及应用方法,能够正确书写离子方程式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学与生活、生产、环境等社会实际密切相关.下列叙述正确的是( )
| A、稀的食盐水能杀死H7N9禽流感病毒 |
| B、涤纶、塑料、光导纤维都是有机高分子材料 |
| C、用电镀厂的废水直接灌溉农田,可提高水的利用率 |
| D、外形似海绵、密度小、有磁性的碳与石墨互为同素异形体 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2.有关该电池的说法正确的是( )
| 放电 |
| 充电 |
| A、放电时负极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、放电过程电子从正极流向负极 |
| C、放电时溶液中正极附近OH-浓度变小 |
| D、充电时电解质溶液中的OH-向阳极移动 |
下列说法正确的是( )


| A、图1表示pH相同的盐酸和醋酸加水稀释时溶液导电能力的变化 |
| B、图1表示物质的量浓度相同的盐酸和醋酸加水稀释时溶液导电能力的变化 |
| C、图2中,t℃时饱和溶液的质量分数为m% |
| D、图2中,若保持温度不变,可以通过添加溶质的方法使溶液组成从a点变为b点 |
2SO2+O2
2SO3是制造硫酸的重要反应.下列关于该反应的说法正确的是( )
| 一定条件 |
| A、使用催化剂不影响反应速率 |
| B、降低体系温度能加快反应速率 |
| C、增加O2的浓度能加快反应速率 |
| D、一定条件下达到反应限度时SO2全部转化为SO3 |
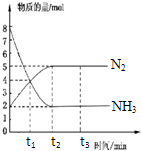 在体积一定的密闭容器中发生反应:2NH3(g)?N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示.下列叙述正确的是( )
在体积一定的密闭容器中发生反应:2NH3(g)?N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示.下列叙述正确的是( )| A、t1时反应达到平衡 |
| B、t3时,v正(N2)>v逆(N2) |
| C、t2时和t3时n(H2)相等 |
| D、t3后,若体积不变充He,反应速率增大 |
下列化学反应对应的离子方程式表示正确的是( )
| A、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| C、少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D、FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |