题目内容
13.甲、乙、丙、丁分别是BaCl2、NaOH、FeCl2、Al2(SO4)3、四种物质中的一种.若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生.据此可推断丙物质是( )| A. | BaCl2 | B. | NaOH | C. | FeCl2 | D. | Al2(SO4)3 |
分析 若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,可知丁为NaOH,乙为Al2(SO4)3;丁溶液滴入甲溶液时,无明显现象发生,可知甲为BaCl2,以此来解答.
解答 解:因NaOH与Al2(SO4)3反应生成白色沉淀,NaOH过量时沉淀溶解,NaOH与FeCl2反应生成白色沉淀迅速变为灰绿色最后为红褐色,则若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,可知丁为NaOH,乙为Al2(SO4)3;丁溶液滴入甲溶液时,无明显现象发生,可知甲为BaCl2,据此可推断丙物质是FeCl2,
故选C.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
3.下列物质属于醇类的是( )
| A. |  | B. |  | C. |  | D. |  |
4.将某一元弱酸(HA)和氢氧化钠溶液混合,所得溶液呈中性,则此溶液中c(Na+)与c(A-)的大小关系为( )
| A. | c(Na+)=c(A-) | B. | c(Na+)<c(A-) | C. | c(Na+)>c(A-) | D. | 无法确定 |
18.广阔的海洋蕴藏着丰富的化学资源,含有几十种元素,下列属于海水中微量元素的是( )
| A. | 氧 | B. | 钠 | C. | 碘 | D. | 氢 |
5.在指定溶液中,下列各组中的离子不能大量共存的是( )
| A. | 由水电离出的c(H+)=1×10-12mol/L的溶液:Al3+、CH3COO-、NH4+、HCO3- | |
| B. | 试KSCN溶液变红的溶液:Na+、SO42-、H2O2、Cl- | |
| C. | 使酚酞变红的溶液:Ag(NH3)2+、CO32-、K+、S2- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液:K+、AlO2-、SiO32-、Na+ |
8.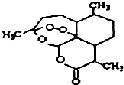 被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
 被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )| A. | 分子式为:C16H20O5 | |
| B. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| C. | 青篙素与维生素一样是水溶性的 | |
| D. | 该化合物中含有过氧键,一定条件下有氧化性 |