题目内容
1.按要求填空:(1)含有相同氧原子数的SO2和SO3:质量之比为6:5.
(2)碳酸钠中含有碳酸氢钠杂质,除去此杂质的简单方法是加热.
(3)写出下列反应的离子方程式
①少量氢氧化钙溶液中加入足量的碳酸氢钠溶液2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O.
②偏铝酸钠溶液中通过量CO2气体AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-.
分析 (1)含有相同氧原子数的SO2和SO3,二氧化硫与三氧化硫的物质的量之比为3:2,依据m=nM计算解答;
(2)依据碳酸氢钠的不稳定性解答;
(3)①少量氢氧化钙溶液中加入足量的碳酸氢钠溶液反应生成碳酸钙、碳酸钠和水;
②二氧化碳过量,二者反应生成氢氧化铝沉淀和碳酸氢钠.
解答 解:(1)含有相同氧原子数的SO2和SO3,二氧化硫与三氧化硫的物质的量之比为3:2,依据m=nM可知二者质量之比为:3×64:2×80=6:5;
故答案为:6:5;
(2)碳酸氢钠性质不稳定受热分解生成碳酸钠和水、二氧化碳,所以可以用加热方法除去碳酸钠中的碳酸氢钠;
故答案为:加热;
(3)①少量氢氧化钙溶液中加入足量的碳酸氢钠溶液反应生成碳酸钙、碳酸钠和水,离子方程式:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O;
故答案为:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O;
②向偏铝酸钠溶液中通过量CO2,反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-.
点评 本题为综合题,考查了物质的除杂、物质的量有关计算、离子方程式的 书写,明确物质的性质及发生反应实质是解题关键,题目难度不大.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 合成氨反应中为了提高正反应速率,及时抽走氨气 | |
| B. | SO2催化氧化中通入过量空气可提高SO2的平衡转化率 | |
| C. | 合成氨中加入催化剂可提高氮气的平衡转化率 | |
| D. | 合成氨反应中缩小容器体积可以使平衡正向移动,所以氮气浓度减小 |
16.下列表格中各项分类都正确的一组是( )
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 纯碱 | 冰水混合物 | 液态KNO3 | 蔗糖 |
| B | CaO | 海水 | 铜 | 乙醇 |
| C | 明矾 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | 氨水 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
6.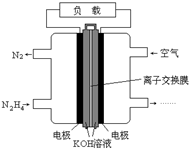 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述正确的是( )
 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述正确的是( )| A. | 电子从右侧电极经过负载后流向左侧电极 | |
| B. | 负极发生的电极反应式为:N2H4-4e-=N2+4H+ | |
| C. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 | |
| D. | 该燃料电池持续放电时.K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
13.甲、乙、丙、丁分别是BaCl2、NaOH、FeCl2、Al2(SO4)3、四种物质中的一种.若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生.据此可推断丙物质是( )
| A. | BaCl2 | B. | NaOH | C. | FeCl2 | D. | Al2(SO4)3 |
 2Fe + 3CO2可用于工业上炼铁,该反应属于
2Fe + 3CO2可用于工业上炼铁,该反应属于