题目内容
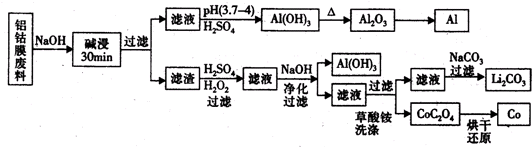
锂离子电池回收具有重要意义.重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机黏结剂.某回收工艺流程如下:
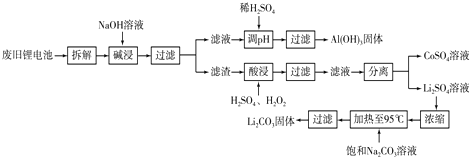
(1)上述工艺回收到的产物有 ;
(2)碱浸时主要反应的离子方程式为 ;
(3)酸浸时反应的化学方程式为 .

(1)上述工艺回收到的产物有
(2)碱浸时主要反应的离子方程式为
(3)酸浸时反应的化学方程式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:铝钴膜废料中含有LiCo02和铝箔,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为LiCo02;通过调节滤液的pH,将偏铝酸钠转化成氢氧化铝沉淀;将滤渣用双氧水、硫酸处理后生成Li2SO4、CoSO4,反应的离子方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,通过操作分别分离出Li2SO4、CoSO4,通过浓缩、加入饱和碳酸钠溶液后过滤,最后得到碳酸锂固体,
(1)根据工艺流程的最终产物可判断回收到的产物,应为Al(OH)3、CoSO4、Li2CO3;
(2)根据所加入的反应物以及生成物结合质量守恒定律和电荷守恒定律来书写离子方程式;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式.
(1)根据工艺流程的最终产物可判断回收到的产物,应为Al(OH)3、CoSO4、Li2CO3;
(2)根据所加入的反应物以及生成物结合质量守恒定律和电荷守恒定律来书写离子方程式;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式.
解答:
解:题干工艺流程为:铝钴膜废料中含有LiCo02和铝箔,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为LiCo02;通过调节滤液的pH,将偏铝酸钠转化成氢氧化铝沉淀;将滤渣用双氧水、硫酸处理后生成Li2SO4、CoSO4,反应的离子方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,通过操作分别分离出Li2SO4、CoSO4,通过浓缩、加入饱和碳酸钠溶液后过滤,最后得到碳酸锂固体,
(1)根据生成流程可知,工艺流程的最终产物有:Al(OH)3、CoSO4、Li2CO3,故答案为:Al(OH)3、CoSO4、Li2CO3;
(2)铝能与碱反应生成AlO2-,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O.
(1)根据生成流程可知,工艺流程的最终产物有:Al(OH)3、CoSO4、Li2CO3,故答案为:Al(OH)3、CoSO4、Li2CO3;
(2)铝能与碱反应生成AlO2-,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O.
点评:本题通过生产流程考查了金属的回收、氧化还原反应、物质的分离提纯和除杂等知识,题目难度中等,涉及的知识点较为综合,做题时注意仔细审题,从题目中获取关键信息.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
闪电时空气中有臭氧生成,下列说法正确的是( )
| A、O3和O2互为同位素 |
| B、O3比O2稳定 |
| C、等质量的O3和O2含有相同的原子数 |
| D、O3与O2的相互转变是物理变化 |
下列叙述正确的是( )
| A、1molH2O的质量为18g/mol |
| B、CH4的摩尔质量为16g |
| C、3.01×1023个SO2分子的质量为32g |
| D、2molNaOH溶于1L水中配成溶液的浓度为2mol?L-1 |
下列各组反应中最终肯定是白色沉淀的是( )
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、FeCl2溶液中加入过量氨水 |
| D、Ca(OH)2溶液中通入过量SO2气体 |
将过量的CO2通入下列溶液中,最终不会出现浑浊的是( )
| A、CaCl2溶液 |
| B、NaAlO2溶液 |
| C、饱和Na2CO3溶液 |
| D、水玻璃 |
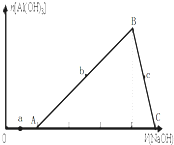 向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )| A、在a点对应的溶液中,加入Mg2+、I-、NH4+、NO3-离子仍能大量共存 |
| B、原溶液中盐酸和AlCl3物质的量的浓度之比为1:3 |
| C、若b、c的纵坐标数值相同,则横坐标数值之比为1:3 |
| D、图中B→C的过程中,实际发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O |
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SO3、K2SiO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:
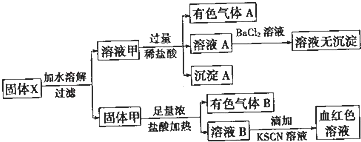
根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A、溶液甲中一定含有K2SiO3、NaNO2 |
| B、无法判断溶液中是否有K2SO3 |
| C、气体A和气体B-定为混合物 |
| D、原混合物中一定有Fe2O3 |