题目内容
有 Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是( )
| A、还原产物为NH4+ |
| B、氧化剂与还原剂的物质的量之比为1:8 |
| C、若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D、若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
考点:氧化还原反应
专题:氧化还原反应专题
分析:由信息可知,Fe2++NO3-+H+→NH4++Fe3++H2O,Fe元素的化合价升高,N元素的化合价降低,以此来解答.
解答:
解:A.N元素的化合价降低,则还原产物为NH4+,故A正确;
B.Fe元素化合价升高,N元素的化合价降低,则氧化剂为NO3-,还原剂为Fe2+,由电子守恒可知,氧化剂与还原剂的物质的量之比为1:8,故B正确;
C.若有0.5mol NO3-参加还原反应,则转移电子为0.5mol×[5-(-3)]=4mol,故C错误;
D.若把该反应设计为电解池,阳极失去电子发生氧化反应,则阳极反应为Fe2+-e→Fe3+,故D正确;
故选C.
B.Fe元素化合价升高,N元素的化合价降低,则氧化剂为NO3-,还原剂为Fe2+,由电子守恒可知,氧化剂与还原剂的物质的量之比为1:8,故B正确;
C.若有0.5mol NO3-参加还原反应,则转移电子为0.5mol×[5-(-3)]=4mol,故C错误;
D.若把该反应设计为电解池,阳极失去电子发生氧化反应,则阳极反应为Fe2+-e→Fe3+,故D正确;
故选C.
点评:本题考查氧化还原反应,为高频考点,把握习题中的信息判断发生的反应及元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
难溶化合物的溶解能力可以用溶度积Ksp来表示,当溶液中相应离子浓度的乘积大于该值时,会形成沉淀.已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17.若在常温下,向5mL含有KCl和KI各为0.01mol/L的溶液中加入8mL 0.01mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是( )
| A、c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B、c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C、c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D、c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
 短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )
短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、元素金属性:甲>丙 |
| C、氢氧化物碱性:丙<丁<戊 |
| D、丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
下列变化过程中未必吸热的是( )
| A、电解质在熔融状态下电离 |
| B、共价键断裂 |
| C、原子失电子 |
| D、溶解 |
下列电池中不属于二次电池的是( )
| A、碱性锌锰电池 | B、铅蓄电池 |
| C、镍镉电池 | D、锂离子电池 |
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为.有关咖啡酸的说法中不正确的是( )
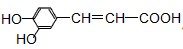
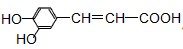
| A、咖啡酸可以发生还原、取代、加聚等反应 |
| B、咖啡酸与FeCl3溶液可以发生显色反应 |
| C、1mol咖啡酸可与4mol H2发生加成反应 |
| D、1mol咖啡酸最多能消耗3mol的NaHCO3 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,5.6L氯气和16.8L氧气的混合气体中含有分子数为NA |
| B、标准状况下,22.4L H2O所含有原子数为3NA |
| C、NA个N2分子所占的体积与0.5NA个H2分子所占的体积比一定是2:1 |
| D、1mol/L NaCl溶液含有2NA个氯离子 |