题目内容
8.分子式为C3H7Br的有机物甲在适宜条件下能发生如下图系列转化: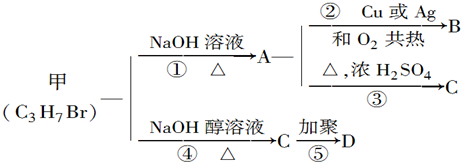
1若B能发生银镜反应,试解答下列问题:
(1)试确定有机物甲的结构简式是CH3CH2CH2Br;
(2)用化学方程式表示下列转化过程
反应①:CH3CH2CH2Br+NaOH$\stackrel{△}{→}$CH3CH2CH2OH+NaBr
B+++OH-→CH3CH2CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3CH2COONH4+3NH3+2Ag↓+H2O
2若B不能发生银镜反应,试解答下列问题:
(1)试确定A的结构简式是CH3CH(OH)CH3;
(2)用化学方程式表示下列转化过程
反应②:
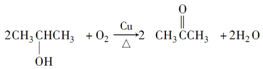
反应④:

反应⑤:
 .
.
分析 甲的分子式为C3H7Br,在氢氧化钠的醇溶液、加热条件下发生消去反应生成C为CH3CH=CH2,C发生加聚反应生成D的结构简式为 ,
,
1.甲在氢氧化钠的水溶液、加热条件下发生水解反应生成A,A氧化生成B,若B能发生银镜反应,则甲为CH3CH2CH2Br,A为CH3CH2CH2OH,B为CH3CH2CHO;
2.若B不能发生银镜反应,则甲为CH3CHBrCH3,A为CH3CH(OH)CH3,B为 ,据此答题.
,据此答题.
解答 解:甲的分子式为C3H7Br,在氢氧化钠的醇溶液、加热条件下发生消去反应生成C为CH3CH=CH2,C发生加聚反应生成D的结构简式为 .
.
1.甲在氢氧化钠的水溶液、加热条件下发生水解反应生成A,A氧化生成B,若B能发生银镜反应,则甲为CH3CH2CH2Br,A为CH3CH2CH2OH,B为CH3CH2CHO.
(1)有机物甲的结构简式为CH3CH2CH2Br,
故答案为:CH3CH2CH2Br;
(2)甲→A的化学方程式为:CH3CH2CH2Br+NaOH$\stackrel{△}{→}$CH3CH2CH2OH+NaBr,
B和银氨溶液反应的化学方程式为:CH3CH2CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3CH2COONH4+3NH3+2Ag↓+H2O,
故答案为:CH3CH2CH2Br+NaOH$\stackrel{△}{→}$CH3CH2CH2OH+NaBr;CH3CH2CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3CH2COONH4+3NH3+2Ag↓+H2O;
2.若B不能发生银镜反应,则甲为CH3CHBrCH3,A为CH3CH(OH)CH3,B为 .
.
(1)A的结构简式为:CH3CH(OH)CH3,
故答案为:CH3CH(OH)CH3;
(2)反应②的方程式为: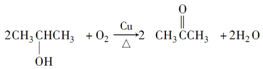 ,反应④的方程式为:
,反应④的方程式为: ,反应⑤的方程式为:
,反应⑤的方程式为: ,
,
故答案为: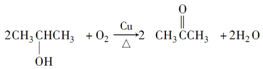 ;
; ;
; .
.
点评 本题考查了有机物的推断,关键是明确C3H7Br有2种同分异构体,再结合反应条件进行推断,熟练掌握有机物的官能团性质,难度不大.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案| A. | 11个质子,12个中子,10个电子 | B. | 18个质子,22个中子,18个电子 | ||
| C. | 16个质子,16个中子,18个电子 | D. | 17个质子,18个中子,17个电子 |
| A. | 5×10-6NA个DEHP分子 | |
| B. | 含有1.2×10-4NA个碳原子的DEHP分子 | |
| C. | 含有2×10-5NA个氧原子的DEHP分子 | |
| D. | 含有2.0×10-4NA个氢原子的DEHP分子 |
| A. | 萃取 | B. | 蒸馏 | C. | 分液 | D. | 渗析 |
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COOH-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3-HCO3-?H++HCO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS-HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4-H2PO4-H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3K2=6.23×10-8 K3=2.20×10-13 |
(1)当升高温度时,K值变大(填“变大”“变小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?K值越大电离出的氢离子浓度越大,所以酸性越强.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是H3PO4,最弱的是HPO42-.
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是K1:K2:K3≈1:10-5:10-10,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(5)Na2CO3溶液呈碱性(填“酸性”“碱性”或“中性”),其原因(用离子方程式表示)是CO32-+H2O?HCO3-+OH-.
(6)已知NaH2PO4溶液呈酸性,则该溶液中c(H3PO4)小于c(HPO42-)(填“大于”或“小于”).
| A. | 还原性:S2-<Cl-<F- | B. | 稳定性:HF>HCl>H2S | ||
| C. | 碱性:KOH<NaOH<Al(OH)3 | D. | 还原性:K>Na>Mg |
| A. | 将一定体积醋酸溶液加水到原来体积的m倍,则pH增大m | |
| B. | 在NaHCO3溶液中,c(Na+)=c(HCO3-)+c(H2CO3) | |
| C. | 25℃,pH=8的NaOH溶液和pH=8的氨水中,由水电离出的c(OH-)不相等 | |
| D. | 25℃,pH=13的Ba(OH)2溶液和pH=1的盐酸中均存在:c(H+)•c(OH-)=1×10-14 |


 ,
, .
.