题目内容
20.比较下列各组性质,其中错误的是( )| A. | 还原性:S2-<Cl-<F- | B. | 稳定性:HF>HCl>H2S | ||
| C. | 碱性:KOH<NaOH<Al(OH)3 | D. | 还原性:K>Na>Mg |
分析 A.非金属性越强,阴离子的还原性越弱;
B.元素的非金属性越强,对应的氢化物越稳定;
C.金属性越强,对应的最高价氧化物的碱性越强;
D.元素的金属性越强,对应的反之的还原性越强.
解答 解:A.非金属性S<Cl<F,非金属性越强,阴离子的还原性越弱,应为S2->Cl->F-,故A错误;
B.非金属性S<Cl<F,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.金属性K>Na>Al,金属性越强,对应的最高价氧化物的碱性越强,故C错误;
D.金属性K>Na>Mg,元素的金属性越强,对应的反之的还原性越强,故D正确.
故选AC.
点评 本题考查学生元素周期律的应用知识,为高频考点,侧重于学生的分析能力的考查,可以根据周期表中同周期和同主族元素性质的递变规律回答,难度不大.

练习册系列答案
相关题目
10.表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明.
(1)已知碘在碘酸钾中的化合价为+5,1mol碘酸钾中共含5mol原子,则碘酸钾的化学式为KIO3.
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
KIO3+5KI+3H2SO4-3K2SO4+3I2+3H2O
(3)要使上述反应生成的I2从溶液中分离出来,某学生设计如下的操作步骤:
A.检验分液漏斗活塞和上口的玻璃塞是否检漏;
B.把10mL碘水和4mL有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.充分振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
F.静置
G.旋开活塞,用烧杯接收下层I2的有机溶液;
H.从分液漏斗上口倒出上层液体;
①补全上述操作A检漏C充分振荡 F静置②该实验中用的萃取剂是四氯化碳
③从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏(填操作名称)
(4)由食用方法和贮藏指南可推测碘酸钾的化学性质之一是不稳定,受热易分解.
(5)用单质碘与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为I2+2KClO3=2KIO3+Cl2.
| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 | (20mg~40mg)/1kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、防潮 |
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
KIO3+5KI+3H2SO4-3K2SO4+3I2+3H2O
(3)要使上述反应生成的I2从溶液中分离出来,某学生设计如下的操作步骤:
A.检验分液漏斗活塞和上口的玻璃塞是否检漏;
B.把10mL碘水和4mL有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.充分振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
F.静置
G.旋开活塞,用烧杯接收下层I2的有机溶液;
H.从分液漏斗上口倒出上层液体;
①补全上述操作A检漏C充分振荡 F静置②该实验中用的萃取剂是四氯化碳
③从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏(填操作名称)
(4)由食用方法和贮藏指南可推测碘酸钾的化学性质之一是不稳定,受热易分解.
(5)用单质碘与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为I2+2KClO3=2KIO3+Cl2.
15.下列化合物不能由两种单质直接化合而成的是( )
| A. | Na2S | B. | Cu2S | C. | FeCl3 | D. | SO3 |
5.100mL 6mol/L硫酸溶液与过量锌粒反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可采取的措施是( )
| A. | 加入少量碳酸钠粉末 | B. | 加入少量硫酸铜溶液 | ||
| C. | 加入适量NaCl溶液 | D. | 加热 |
12.下列物质可用分液漏斗分离的是( )
| A. | 碘与酒精 | B. | 甲醛与水 | C. | 溴苯和NaOH溶液 | D. | 甘油和水 |
9.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氢原子的氢气在标准状况下的体积约为22.4L | |
| B. | 25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA | |
| C. | 2.3g金属钠变为钠离子失去电子数为0.05NA | |
| D. | 标准状况下,11.2LH2O 含有的分子数为0.5NA |
10.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | 金刚石的熔点低于石墨 | 金刚石是原子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
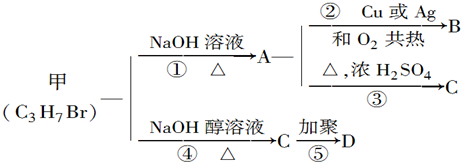
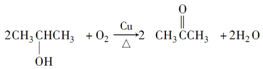

 .
.