题目内容
在温度不变、恒容的容器中进行反应H2?2H△H>0,若反应物的浓度由0.1mol?L-1降到0.06mol?L-1需20s,那么由0.06mol?L-1降到0.036mol?L-1,所需反应时间应( )
| A、等于10 s |
| B、等于12 s |
| C、大于12 s |
| D、小于12 s |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:随着反应物浓度的减小,化学反应速率减慢,反应所需时间增多,依此解答.
解答:
解:反应物的浓度由0.1mol?L-1降到0.06mol?L-1需20s,即反应物的浓度变化为0.1-0.06=0.04mol?L-1,
反应物的浓度由0.06mol?L-1降到0.036mol?L-,即反应物的浓度变化为0.06-0.036=0.024mol?L-1,若反应速率不变,则所需时间为
×20=12s,但随着浓度的减小,反应速率逐渐减小,故所需时间大于12s,
故选C.
反应物的浓度由0.06mol?L-1降到0.036mol?L-,即反应物的浓度变化为0.06-0.036=0.024mol?L-1,若反应速率不变,则所需时间为
| 0.024 |
| 0.04 |
故选C.
点评:本题考查难度对化学反应速率的影响,难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
在甲、乙两个密闭容器中,分别充入HI、NO2,发生反应:(甲)2HI(g)?H2(g)+I2(g)△H>0,(乙)2NO2(g)?N2O4(g)△H<0.下列措施能使两个容器中混合气体颜色均加深且平衡发生移动的是( )
| A、增大反应物浓度 |
| B、增大压强(减小体积) |
| C、降温 |
| D、加催化剂 |
下列溶液与铝不能发生反应产生氢气的是( )
| A、盐酸溶液 |
| B、氢氧化钠溶液 |
| C、氯化铵溶液 |
| D、硫酸钠溶液 |
在以下变化中,加入氧化剂才能实现的是( )
| A、Cl-→Cl2 |
| B、SO42-→BaSO4 |
| C、Cl2→Cl- |
| D、MnO4-→Mn2+ |
下列各组物质中,无论以任何比例混合,其密度不变的是( )
| A、CO与C2H4 |
| B、C2H6与C2H4 |
| C、CO2与C3H6 |
| D、CH4与C2H4 |
下列溶液一定呈中性的是( )
| A、将pH=5的盐酸稀释100倍所得溶液 |
| B、c(H+)=c(OH-)=1×10-6mol/L的溶液 |
| C、由强酸、强碱等物质的量反应得到的溶液 |
| D、非电解质溶于水得到的溶液 |
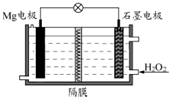 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A、Mg 电极是该电池的正极 |
| B、H2O2在石墨电极上发生还原反应 |
| C、石墨电极附近溶液的pH 减小 |
| D、溶液中Cl-向正极移动 |
常温下,将V1 mL、c1 mol?L-1的氨水滴加到V2 mL、c2 mol?L-1的盐酸中,下列结论合理的是( )
| A、若混合溶液的pH>7,则一定有c1?V1≥c2?V2 |
| B、若V1=V2,c1=c2,则混合液中c(NH+4)>c(Cl-) |
| C、若混合液的 pH=7,则混合液中c(NH4+)=c(Cl-) |
| D、若V1=V2,且混合液的pH<7,则一定有c1<c2 |
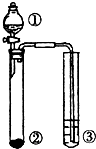 利用图示实验装置,能达到实验目标的是( )
利用图示实验装置,能达到实验目标的是( )