题目内容
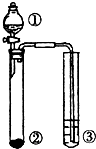 利用图示实验装置,能达到实验目标的是( )
利用图示实验装置,能达到实验目标的是( )| ① | ② | ③ | 实验目标 | |
| A | 浓盐酸 | MnO2 | 滴有少量KSCN的FeCl2溶液 | 验证FeCl2的还原性 |
| B | 浓氨水 | 生石灰 | AlCl3溶液 | 验证Al(OH)3的两性 |
| C | H2O | 金属钠 | 乙醛溶液 | 验证乙醛能与氢气发生加成反应 |
| D | 硫酸 | Na2CO3 | Na2SiO3溶液 | 验证非金属性:S>C>Si |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.浓盐酸和MnO2制取氯气时需要使用固液混合加热型装置;
B.氢氧化铝不溶于弱碱;
C.氢气和乙醛发生加成反应时需要加热且乙醛必须是纯净物;
D.非金属元素最高价氧化物是水化物酸性越强,其非金属性越强,根据强酸制取弱酸判断.
B.氢氧化铝不溶于弱碱;
C.氢气和乙醛发生加成反应时需要加热且乙醛必须是纯净物;
D.非金属元素最高价氧化物是水化物酸性越强,其非金属性越强,根据强酸制取弱酸判断.
解答:
解:A.浓盐酸和MnO2制取氯气时需要使用固液混合加热型装置,该装置的反应装置不加热,浓盐酸和二氧化锰不反应,所以不能达到实验目的,故A错误;
B.浓氨水和生石灰能得到氨气,氨气极易溶于水,所以③会产生倒吸现象,且氨气和氯化铝溶液得到的氢氧化铝不溶于氨水,所以不能达到实验目的,故B错误;
C.氢气和乙醛发生加成反应时需要加热且乙醛必须是纯净物,所以③不能是乙醛溶液、且没有加热,所以不能达到实验目的,故C错误;
D.硫酸能和碳酸钠反应制得二氧化碳,二氧化碳和硅酸钠溶液反应生成不溶性的硅酸,所以该实验证明酸性H2SO4>H2CO3>H2SiO3,则非金属性S>C>Si,故D正确;
故选D.
B.浓氨水和生石灰能得到氨气,氨气极易溶于水,所以③会产生倒吸现象,且氨气和氯化铝溶液得到的氢氧化铝不溶于氨水,所以不能达到实验目的,故B错误;
C.氢气和乙醛发生加成反应时需要加热且乙醛必须是纯净物,所以③不能是乙醛溶液、且没有加热,所以不能达到实验目的,故C错误;
D.硫酸能和碳酸钠反应制得二氧化碳,二氧化碳和硅酸钠溶液反应生成不溶性的硅酸,所以该实验证明酸性H2SO4>H2CO3>H2SiO3,则非金属性S>C>Si,故D正确;
故选D.
点评:本题考查了化学实验方案评价,涉及非金属性强弱判断、物质性质的检验等知识点,明确物质反应条件、物质的性质是解本题关键,注意实验方案的合理性、可操作性、可行性的分析,易错选项是A.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
将足量镁条投入到硫酸和硫酸铜的混合溶液中,充分反应后,镁条质量不变.则原溶液中硫酸与硫酸铜的物质的量浓度之比为( )
| A、10:3 | B、5:3 |
| C、1:4 | D、1:1 |
下列各组物质混合后,只能生成一种含钠化合物的是( )
| A、Na2CO3、盐酸 |
| B、NaOH溶液、CO2 |
| C、NaHCO3溶液、石灰水 |
| D、Na2O2、CO2 |
在温度不变、恒容的容器中进行反应H2?2H△H>0,若反应物的浓度由0.1mol?L-1降到0.06mol?L-1需20s,那么由0.06mol?L-1降到0.036mol?L-1,所需反应时间应( )
| A、等于10 s |
| B、等于12 s |
| C、大于12 s |
| D、小于12 s |
仅用一种试剂就能将苯、裂化汽油、四氯化碳、酒精、碘化钾淀粉溶液五种物质一次性鉴别出来的是( )
①溴水 ②KMnO4 酸性溶液 ③稀硫酸 ④烧碱水.
①溴水 ②KMnO4 酸性溶液 ③稀硫酸 ④烧碱水.
| A、仅① | B、仅①② |
| C、仅①②③ | D、②③④ |
白钨矿(主要成分为CaWO4)是一种重要的含钨矿物,CaWO4中钨元素(W)的化合价是( )
| A、+6 | B、+4 | C、+2 | D、-2 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2L气体(标准状况下) |
| B、6.5g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1 NA |
| C、1.00 L 1.00 mol?L-1 Na2CO3溶液中,CO32-所带电荷总数为2NA |
| D、标准状况下,22.4 L HCl溶于水后溶液中含有nA个HCl分子 |
关于如图各实验装置的叙述正确的是( )

| A、装置甲可用于蒸干NH4Cl饱和溶液制备NH4Cl |
| B、装置乙可用于实验室制备少量氢气、氯气等 |
| C、装置丙可用于实验室检验麦芽糖中是否含有醛基 |
| D、装置丁可用于实验室干燥并收集氨气,同时进行尾气处理,防止污染大气 |