题目内容
下列溶液一定呈中性的是( )
| A、将pH=5的盐酸稀释100倍所得溶液 |
| B、c(H+)=c(OH-)=1×10-6mol/L的溶液 |
| C、由强酸、强碱等物质的量反应得到的溶液 |
| D、非电解质溶于水得到的溶液 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:A、酸溶液稀释仍为酸;
B、中性溶液中氢离子浓度和氢氧根离子浓度相等;
C、二元强酸与一元强碱等物质的量反应时,酸过量;
D、二氧化硫溶于水得到亚硫酸溶液.
B、中性溶液中氢离子浓度和氢氧根离子浓度相等;
C、二元强酸与一元强碱等物质的量反应时,酸过量;
D、二氧化硫溶于水得到亚硫酸溶液.
解答:
解:A、酸溶液稀释仍为酸,所以将pH=5的盐酸稀释100倍所得溶液仍显酸性,故A错误;
B、中性溶液中氢离子浓度和氢氧根离子浓度相等,则c(H+)=c(OH-)=1×10-6mol/L的溶液为中性溶液,故B正确;
C、二元强酸与一元强碱等物质的量反应时,酸过量,所以由强酸、强碱等物质的量反应得到的溶液不一定显中性,故C错误;
D、二氧化硫为非电解质,二氧化硫溶于水得到亚硫酸溶液,亚硫酸溶液显酸性,故D错误.
故选B.
B、中性溶液中氢离子浓度和氢氧根离子浓度相等,则c(H+)=c(OH-)=1×10-6mol/L的溶液为中性溶液,故B正确;
C、二元强酸与一元强碱等物质的量反应时,酸过量,所以由强酸、强碱等物质的量反应得到的溶液不一定显中性,故C错误;
D、二氧化硫为非电解质,二氧化硫溶于水得到亚硫酸溶液,亚硫酸溶液显酸性,故D错误.
故选B.
点评:本题考查了溶液酸碱性的判断,属于易错题,注意不能根据溶液的PH值判断溶液的酸碱性,要根据氢离子浓度和氢氧根离子浓度的相对大小判断溶液的酸碱性.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
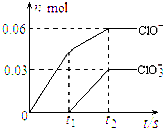 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、反应中转移电子的物质的量是0.21mol |
| B、ClO3-的生成是由于温度升高引起的 |
| C、苛性钾溶液中KOH的质量是16.8g |
| D、氯气被还原成0.06molClO-和0.03molClO3- |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,3.2 g O3所含电子数为1.2 NA |
| B、常温常压下,34g H2O2中含有质子的数目为34 NA |
| C、标准状况下,11.2 L CO与11.2 L O2混合所含原子数为2NA |
| D、0.1 mol CO32-,所含电子数为38NA |
在温度不变、恒容的容器中进行反应H2?2H△H>0,若反应物的浓度由0.1mol?L-1降到0.06mol?L-1需20s,那么由0.06mol?L-1降到0.036mol?L-1,所需反应时间应( )
| A、等于10 s |
| B、等于12 s |
| C、大于12 s |
| D、小于12 s |
一些科学家采用高质子导电性的SCY陶瓷(能传递H+),利用电解原理实现了氨的电化学合成,该过程N2和H2的转化率远高于现在工业上使用的氨合成法.对于电化学化合氨的有关叙述正确的是( )
| A、N2在阴极上被氧化 | ||||
| B、可选用铁作为阳极材料 | ||||
| C、负极的电极反应式:N2+6e-+6H+═2NH3 | ||||
D、该过程的总反应式是N2+3H2
|
白钨矿(主要成分为CaWO4)是一种重要的含钨矿物,CaWO4中钨元素(W)的化合价是( )
| A、+6 | B、+4 | C、+2 | D、-2 |
向三份0.1mol?L-1CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、NaCl固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
| A、减小、增大、减小 |
| B、增大、减小、不变 |
| C、减小、增大、不变 |
| D、增大、减小、增大 |
判断食物的酸碱性,是根据食物进入人体后所生成的最终代谢物的酸碱性而定.含氮、磷等非金属元素较多食物,为酸性食物;含钠、钾、钙、镁等金属元素食物较多,为碱性食物.对食物的酸、碱性判断正确的是
( )
( )
| A、苹果是酸性食物 |
| B、猪肉、牛肉是碱性食物 |
| C、大米、面包是碱性食物 |
| D、巧克力、奶油是酸性食物 |