题目内容
5.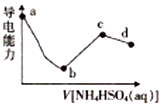 向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )
向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )| A. | b点溶液中只存在H2O的电离平衡和BaSO4的沉淀溶解平衡 | |
| B. | c 点滚液中:c(H+)+c(NH4+)=c(NH3•H2O)+c(OH-) | |
| C. | ab段反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | bc段之间存在某点,其溶液中:c(NH4+)=2c(SO42-) |
分析 根据导电能力随滴入溶液体积的变化如图可知,b点时导电能力最弱,则n(NH4HSO4)=n[Ba(OH)2],该点溶液中发生的反应为NH4HSO4+Ba(OH)2=BaSO4↓+NH3•H2O+H2O,该点溶液中的溶质为NH3•H2O;
c点时导电能力最强,n(NH4HSO4)=2n[Ba(OH)2],该点溶液中发生的反应为2NH4HSO4+Ba(OH)2=BaSO4↓+(NH4)2SO4+2H2O,该点溶液中溶质为 (NH4)2SO4,(NH4)2SO4是强酸弱碱盐;据此分析解答.
解答 解:A.b点时导电能力最弱,则n(NH4HSO4)=n[Ba(OH)2],该点溶液中发生的反应为NH4HSO4+Ba(OH)2=BaSO4↓+NH3•H2O+H2O,该点溶液中的溶质为NH3•H2O,所以b点溶液中存在H2O、NH3•H2O的电离平衡和BaSO4的沉淀溶解平衡,故A错误;
B.c点时导电能力最强,n(NH4HSO4)=2n[Ba(OH)2],该点溶液中发生的反应为2NH4HSO4+Ba(OH)2=BaSO4↓+(NH4)2SO4+2H2O,该点溶液中溶质为 (NH4)2SO4,所以根据电荷守恒:c(H+)+c(NH4+)=2c(SO42-)+c(OH-),又溶液2c(SO42-)>c(NH3•H2O),所以c(H+)+c(NH4+)>c(NH3•H2O)+c(OH-),故B错误;
C.根据以上分析,ab段反应的离子方程式为NH4++Ba2++2OH-+H++SO42-=BaSO4↓+H2O+NH3•H2O,故C错误;
D.根据以上分析,b点溶液中的溶质为NH3•H2O显碱性,而c点溶液中溶质为 (NH4)2SO4,水解显酸性,所以bc段之间存在某点,可以显中性,根据电荷守恒:c(H+)+c(NH4+)=2c(SO42-)+c(OH-),则c(NH4+)=2c(SO42-),故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确各点发生的反应及溶液中溶质成分是解本题关键,侧重考查学生分析判断能力,能正确书写各段反应方程式,题目难度中等.

| A. | 1mol/L的醋酸溶液中c(H+)=0.01 mol/L | |
| B. | 醋酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 醋酸溶液的导电性比盐酸的弱 |
| A. | 天然气、酒精分别属于化石能源、可再生能源 | |
| B. | 金属在潮湿空气中生锈,主要是发生析氢腐蚀 | |
| C. | NaClO具有强氧化性,可作织物漂白剂 | |
| D. | 高纯硅广泛应用于太阳能电池和半导体材料的制造 |
| A. | 制造普通玻璃的主要原料是纯碱、石灰石和石英 | |
| B. | 盛放烧碱溶液的试剂瓶不能用玻璃塞 | |
| C. | 玻璃在加热熔化时有固定的熔点 | |
| D. | 普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅 |
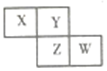 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )| A. | W的原子序数不可能是X的原子序数的3倍 | |
| B. | Z元素可能为金属 | |
| C. | 四种元素的原子有可能均能与氢原子形成18电子分子 | |
| D. | W的气态氢化物的稳定性一定比Y的强 |

| A. | a电极是该电池的负极,发生氧化反应 | |
| B. | b电极反应式为2NO3-+10e-+12H+═N2↑+6H2O | |
| C. | 电池工作时,H+由左室通过质子交换膜进入右室 | |
| D. | 转化室中发生反应后溶液的pH增大(忽略体积变化) |
| A. | I2 | B. | Si3N4 | C. | CO2 | D. | Si |
| A. | 酸式滴定管未用盐酸润洗就直接注入标准盐酸 | |
| B. | 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 | |
| C. | 酸式滴定管在滴定前有气泡,滴定后气泡消失 | |
| D. | 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
| A. | 在水蒸气、液态水和冰中,水分子都在不停地运动 | |
| B. | NaCl溶于水后,因为共价键被破坏,从而形成了Na+和Cl- | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 |