题目内容
4.含苯酚的工业废水的方案如图所示: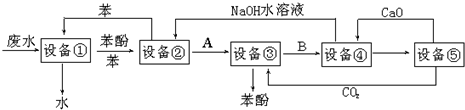
回答下列问题:
(1)设备①进行的是分液操作(填写操作名称),实验室这一步操作所用的仪器是分液漏斗;
(2)设备②中发生的反应方程式为C6H5ONa+H2O+CO2→C6H5OH+NaHCO3;
(3)在设备③中发生反应的化学方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;由设备③进入设备④的物质B是NaHCO3;
(4)在设备④中,物质B的水溶液和CaO反应,产物是CaCO3、NaOH和水,可通过过滤操作(填写操作名称)分离产物;
(5)图中,能循环使用的物质是C6H6、CaO、CO2、NaOH.
分析 由流程可知,设备①中含有苯酚和工业废水,可经萃取、分液得到苯酚的苯溶液混合物,进入设备②,设备②加入氢氧化钠溶液,可得到苯酚钠,在设备③中通入二氧化碳可得到苯酚,发生C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,设备④中的主要物质为NaHCO3,在溶液中加入氧化钙,可生成氢氧化钠和碳酸钙沉淀,
(1)工业废水与苯进入设备①得到苯酚、苯的溶液与可以排放的无酚工业废水,说明在设备①中进行的是萃取;
(2)反应②为苯酚与氢氧化钠溶液反应生成苯酚钠和水,据此写出反应的化学方程式;
(3)设备③苯酚钠溶液通入过量二氧化碳,生成苯酚和碳酸氢钠;设备③中分离出苯酚,则③进入设备④的为碳酸氢钠;
(4)物质B为碳酸氢钠溶液,碳酸氢钠与氧化钙反应生成碳酸钙沉淀和强氧化钠,然后通过过滤可以分离出碳酸钙和氢氧化钠;
(5)根据生产流程图中的物质,找出反应物与生成物,然后分析生成物中的物质被用作反应物的即为可循环利用的物质.
解答 解:由流程可知,设备①中含有苯和工业废水,可经萃取、分液得到苯酚的苯溶液混合物,进入设备②,设备②加入氢氧化钠溶液,可得到苯酚钠,在设备③中通入二氧化碳可得到苯酚,发生C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,设备④中的主要物质为NaHCO3,在溶液中加入氧化钙,可生成氢氧化钠和碳酸钙沉淀,
(1)工业废水与苯进入设备①得到苯酚、苯的溶液与可以排放的无酚工业废水,说明在设备①中进行的是萃取,利用苯与苯酚相似的结构互溶与水不溶,将苯酚从工业废水里提取出来,用分液的方法将下层的工业废水放出排放,上层的苯酚、苯混合液进入设备②;萃取、分液必须用到的仪器名称叫分液漏斗,
故答案为:分液;分液漏斗;
(2)反应②中苯酚与氢氧化钠溶液反应生成苯酚钠和水,反应的化学方程式为:C6H5ONa+H2O+CO2→C6H5OH+NaHCO3,
故答案为:C6H5ONa+H2O+CO2→C6H5OH+NaHCO3;
(3)依据碳酸性比苯酚的酸性强,弱酸盐与“强”酸发生的复分解反应,二氧化碳和苯酚钠反应生成苯酚,反应的方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,所以由设备③进入设备④的物质B是NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;NaHCO3;
(4)盛有碳酸氢钠溶液的设备④中,加入生石灰,生石灰与碳酸氢钠溶液里的水反应生成氢氧化钙,熟石灰和与碳酸氢钠发生复分解反应,生成碳酸钙沉淀、水、氢氧化钠,有关反应方程式为:CaO+H2O=Ca(OH)2,Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O,所以产物为CaCO3、NaOH和水,可通过过滤操作分离出碳酸钙和氢氧化钠,
故答案为:CaCO3;过滤;
(5)设备⑤应是石灰窑,CaCO3高温分解所得的产品是氧化钙和二氧化碳,所得二氧化碳通入设备③,反应所得氧化钙进入设备④.在含苯酚工业废水提取苯酚的工艺流程中,苯、氧化钙、CO2、和NaOH理论上应当没有消耗,它们均可以循环使用,
故答案为:CO2;NaOH.
点评 本题考查了化学实验基本操作方法的综合应用,题目难度中等,明确工艺流程及反应原理为解答关键,注意掌握化学实验基本操作方法,试题侧重考查学生的分析能力及化学实验能力.

| A. | 1.08mol•L-1 | B. | 1.37mol•L-1 | C. | 1.54mol•L-1 | D. | 2.48mol•L-1 |
| A. | 标准状况下,22.4L SO3中含有的分子数为NA个 | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2mol NO和1mol O2充分反应,产物的分子数为2NA |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 高纯硅可用于制造光导纤维 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 硅在电子工业中,是重要的半导体材料 |
| A. | 单位体积内活化分子数增多 | B. | 活化分子百分含量增多 | ||
| C. | 单位体积内活化分子数不变 | D. | 活化分子百分含量减少 |
| A. |  制乙酸乙酯 | B. |  制氢氧化亚铁 | C. |  石油的蒸馏 | D. |  实验室制乙烯 |
| A. | 1molH3PO4的质量为98g•mol-1 | B. | H3PO4的摩尔质量为98g | ||
| C. | 9.8g H3PO4含有NA个H3PO4分子 | D. | NA个H3PO4分子的质量为98g |