题目内容
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、 制取干燥的氨气 |
B、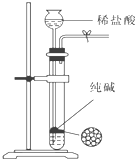 可用于制取少量纯净的CO2气体 |
C、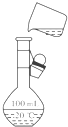 将溶液定容到100mL |
D、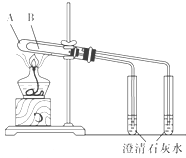 可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.氨气能和浓硫酸反应;
B.碳酸钠为固体粉末不是块状固体,所以不能使用启普发生器;
C.定容时用胶头滴管;
D.较高温度下碳酸钠不分解、较低温度下碳酸氢钠分解,则碳酸钠稳定性大于碳酸氢钠.
B.碳酸钠为固体粉末不是块状固体,所以不能使用启普发生器;
C.定容时用胶头滴管;
D.较高温度下碳酸钠不分解、较低温度下碳酸氢钠分解,则碳酸钠稳定性大于碳酸氢钠.
解答:
解:A.氨气属于碱性气体,氨气能和浓硫酸反应,所以不能用浓硫酸干燥氨气,应该用碱石灰干燥氨气,故A错误;
B.碳酸钠为固体粉末不是块状固体,所以不能使用启普发生器,如果用石灰石和稀盐酸制取二氧化碳就可以用启普发生器,故B错误;
C.当溶液液面离刻度线2-3cm时,用胶头滴管定容,故C错误;
D.如果左边试管溶液不变浑浊右边试管溶液变浑浊,说明碳酸氢钠分解生成二氧化碳、碳酸钠不分解,较高温度下碳酸钠不分解、较低温度下碳酸氢钠分解,说明碳酸钠稳定性大于碳酸氢钠,故D正确;
故选D.
B.碳酸钠为固体粉末不是块状固体,所以不能使用启普发生器,如果用石灰石和稀盐酸制取二氧化碳就可以用启普发生器,故B错误;
C.当溶液液面离刻度线2-3cm时,用胶头滴管定容,故C错误;
D.如果左边试管溶液不变浑浊右边试管溶液变浑浊,说明碳酸氢钠分解生成二氧化碳、碳酸钠不分解,较高温度下碳酸钠不分解、较低温度下碳酸氢钠分解,说明碳酸钠稳定性大于碳酸氢钠,故D正确;
故选D.
点评:本题考查实验方案评价,涉及气体干燥、仪器的使用、基本实验操作等知识点,明确物质性质、反应原理、基本实验操作等知识点即可解答,从评价性、安全性等方面分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是( )
| A、将体积相同的pH=4的盐酸和醋酸都稀释成pH=5的溶液,醋酸所需加入的水量比盐酸的多 |
| B、盐酸和醋酸都可用相应的钠盐与浓酸酸反应制取 |
| C、相同物质的量浓度、相同体积的盐酸和醋酸溶液分别跟氢氧化钠溶液反应时,消耗氢氧化钠的量相等 |
| D、相同pH值的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向反应后的腐蚀液(还有剩余氯化铁)中同时加入一定量铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
| A、烧杯中固体有铜无铁 |
| B、烧杯中溶液有Fe3+、Fe2+,无Cu2+ |
| C、烧杯中固体铁、铜都有,溶液中只有Fe2+ |
| D、烧杯中铁、铜都无,溶液有Fe2+、Cu2+ |
下列物质中,含有共价键的离子化合物是( )
| A、NaCl |
| B、H2O |
| C、CaCl2 |
| D、KOH |
下列离子反应方程式正确的是( )
| A、碳酸氢钠溶液跟过量的饱和石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| B、向Ba(OH)2溶液中滴加NaHSO4溶液至溶液显中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| C、氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
| D、澄清石灰水中通入少量CO2:Ca(OH)2+CO2═CaCO3↓+H2O |
下列说法正确的是( )
| A、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B、某无色溶液滴入澄清石灰水中,石灰水变浑浊,则该溶液中可能含HCO3- |
| C、某无色溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定有Ag+ |
| D、向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe3十 |
在①金刚石、②晶体硅、③P4、④SiO2、⑤CH4、⑥CH2Cl2、⑦CCl4、⑧NH+4微粒中,分子结构是正四面体的是( )
| A、①②③⑤⑦ | B、①②④ |
| C、③⑤⑦ | D、④⑥⑧ |
配制0.1mol/LCuSO4溶液,可采用的方法是( )
| A、将25g胆矾溶于1L水中 |
| B、将25g胆矾溶于水,配成1L溶液 |
| C、取16g胆矾溶于水,再稀释到1L |
| D、称取16g无水CuSO4,溶于水配成1L溶液 |
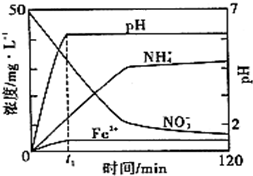 I.铁盐、亚铁盐是实验室常用的药品.
I.铁盐、亚铁盐是实验室常用的药品.