题目内容
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是( )
| A、将体积相同的pH=4的盐酸和醋酸都稀释成pH=5的溶液,醋酸所需加入的水量比盐酸的多 |
| B、盐酸和醋酸都可用相应的钠盐与浓酸酸反应制取 |
| C、相同物质的量浓度、相同体积的盐酸和醋酸溶液分别跟氢氧化钠溶液反应时,消耗氢氧化钠的量相等 |
| D、相同pH值的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:只要能证明HCl电离程度大于醋酸电离程度就能证明盐酸是强酸、醋酸是弱酸,据此分析解答.
解答:
解:A.将体积相同的pH=4的盐酸和醋酸都稀释成pH=5的溶液,醋酸所需加入的水量比盐酸的多,说明醋酸中存在电离平衡,所以能证明醋酸是弱酸、盐酸是强酸,故A正确;
B.浓硫酸和NaCl、醋酸钠反应制取HCl、醋酸是利用浓硫酸的难挥发性,不能说明醋酸电离程度小于HCl,所以不能证明醋酸是弱酸、盐酸是强酸,故B错误;
C.中和等物质的量的醋酸和盐酸消耗氢氧化钠的物质的量相等,说明醋酸和盐酸都是一元酸,不能说明醋酸电离程度小于HCl,所以不能证明醋酸是弱酸、盐酸是强酸,故C错误;
D.反应速率与氢离子浓度成正比,pH相等的醋酸和盐酸中氢离子浓度相等,所以反应开始速率相等,与电解质强弱无关,所以不能证明醋酸是弱酸、盐酸是强酸,故D错误;
故选A.
B.浓硫酸和NaCl、醋酸钠反应制取HCl、醋酸是利用浓硫酸的难挥发性,不能说明醋酸电离程度小于HCl,所以不能证明醋酸是弱酸、盐酸是强酸,故B错误;
C.中和等物质的量的醋酸和盐酸消耗氢氧化钠的物质的量相等,说明醋酸和盐酸都是一元酸,不能说明醋酸电离程度小于HCl,所以不能证明醋酸是弱酸、盐酸是强酸,故C错误;
D.反应速率与氢离子浓度成正比,pH相等的醋酸和盐酸中氢离子浓度相等,所以反应开始速率相等,与电解质强弱无关,所以不能证明醋酸是弱酸、盐酸是强酸,故D错误;
故选A.
点评:本题考查强弱电解质的判断,明确强弱电解质本质“电离程度”即可解答,注意反应速率与离子浓度有关,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
下列物质中,存在的化学键种类最多的是( )
| A、NaOH |
| B、HClO |
| C、MgCl2 |
| D、NH4Cl |
0.1mol某单质跟足量的硫充分反应后,其质量增加1.6g.则组成这种单质的元素可能是( )
| A、Cu | B、Al | C、Zn | D、Fe |
下列判断正确的是( )
| A、原子半径:Cl>Mg>Na |
| B、酸性:H2SiO3>H2CO3>HNO3 |
| C、稳定性:HF<NH3<CH4 |
| D、碱性:LiOH<NaOH<KOH |
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、 制取干燥的氨气 |
B、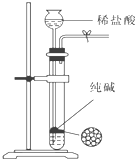 可用于制取少量纯净的CO2气体 |
C、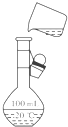 将溶液定容到100mL |
D、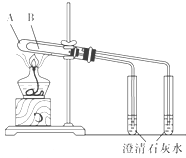 可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、18g D2O中含有质子的数目为NA |
| B、0.1molCl2完全反应,转移的电子数一定为0.2NA |
| C、室温下,46 g NO2和N2O4的混合气体中含有氮原子数为NA |
| D、1 L 1mol?L-1的Na2CO3溶液中,阴离子总数为NA |