题目内容
仔细阅读下图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去).请按要求回答: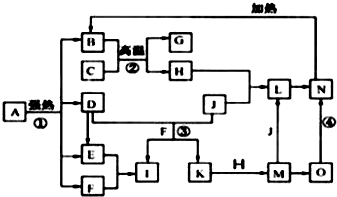
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14.A强热分解的化学反应方程式为 .
(2)写出反应②在工业生产上的一种用途: .
(3)反应③的离子方程式为 ;反应④的化学方程式为 .
(4)K和Q溶液是检验I溶液中阴离子的常见试剂,以Pt为电极电解1L0.1mol/LQ的水溶液,当电路中通过0.1mol电子时,溶液的pH为 (设电解过程溶液体积不变),阳极的电极反应式为 .
(5)常以C或H制成容器盛装和运输I的浓溶液,其原理是 .

(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14.A强热分解的化学反应方程式为
(2)写出反应②在工业生产上的一种用途:
(3)反应③的离子方程式为
(4)K和Q溶液是检验I溶液中阴离子的常见试剂,以Pt为电极电解1L0.1mol/LQ的水溶液,当电路中通过0.1mol电子时,溶液的pH为
(5)常以C或H制成容器盛装和运输I的浓溶液,其原理是
考点:无机物的推断
专题:推断题
分析:F是氧化物和氢化物,且F在常温下为液态,则F是H2O,C、H是日常生活中最常见的金属单质,应该为Al和Fe,结合转化关系中,B+C=G+H,可知是铝热反应,C为Al,H为Fe,G是Al2O3,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M,M和J反应生成L,所以L为FeCl3,M为FeCL2,J为Cl2,判断K为HCl;D是形成酸雨的主要污染物判断为SO2,则I是H2SO4,E为SO3,再结合题目分析解答.
解答:
解:F是氧化物和氢化物,且F在常温下为液态,则F是H2O,C、H是日常生活中最常见的金属单质,应该为Al和Fe,结合转化关系中,B+C=G+H,可知是铝热反应,C为Al,H为Fe,G是Al2O3,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M,M和J反应生成L,所以L为FeCl3,M为FeCL2,J为Cl2,判断K为HCl;D是形成酸雨的主要污染物判断为SO2,则I是H2SO4,E为SO3,
(1)反应①是分解反应,反应中生成的B(Fe2O3)、D(SO2)、E(SO3)、F(H2O)的物质的量之比为1:1:1:14,依据反应前后原子守恒可以推断出A的化学式,为FeSO4?7H2O,配平化学方程式得到:2(FeSO4?7H2O)
Fe2O3+SO2↑+SO3↑+14H2O,
故答案为:2FeSO4?7H2O
Fe2O3+SO2↑+SO3↑+14H2O;
(2)反应②是铝热反应,反应易引发,反应放出大量热量,在工业生产上的一种用途是野外焊接钢轨,故答案为:焊接钢轨;
(3)反应③是二氧化硫和氯气在水溶液中的反应生成硫酸和盐酸,反应的离子方程式:Cl2+SO2+2H2O═4H++SO42-+2Cl-;反应④是氢氧化亚铁被氧化生成氢氧化铁的反应的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3 ,
故答案为:Cl2+SO2+2H2O═4H++SO42-+2Cl-;4Fe(OH)2+O2+2H2O═4Fe(OH)3 ;
(4)K为HCl,I是H2SO4,K和Q溶液是检验I溶液中阴离子的常见试剂,则Q是BaCl2,以Pt为电极电解1L0.1mol/LBaCl2的水溶液,阳极上氯离子放电生成氯气,电极反应式为 2Cl--2e-=Cl2↑,阴极上氢离子放电生成氢气,电极反应式为 2H++2e-=H2↑,当电路中通过0.1mol电子时,溶液中生成c(OH-)=
=0.1mol/L,则溶液的pH为13,故答案为:13;2Cl--2e-=Cl2↑;
(5)C是Al、H是Fe,I是H2SO4,常温下冷的浓硫酸与铁或铝能发生钝化现象而阻止进一步被氧化,所以可用铁或铝制容器储运浓硫酸,
故答案为:冷的浓硫酸与铁或铝制容器接触时,在表面生成一层致密的氧化膜,阻止金属继续与酸反应而使金属“钝化”,所以可用铁或铝制容器储运浓硫酸.
(1)反应①是分解反应,反应中生成的B(Fe2O3)、D(SO2)、E(SO3)、F(H2O)的物质的量之比为1:1:1:14,依据反应前后原子守恒可以推断出A的化学式,为FeSO4?7H2O,配平化学方程式得到:2(FeSO4?7H2O)
| ||
故答案为:2FeSO4?7H2O
| ||
(2)反应②是铝热反应,反应易引发,反应放出大量热量,在工业生产上的一种用途是野外焊接钢轨,故答案为:焊接钢轨;
(3)反应③是二氧化硫和氯气在水溶液中的反应生成硫酸和盐酸,反应的离子方程式:Cl2+SO2+2H2O═4H++SO42-+2Cl-;反应④是氢氧化亚铁被氧化生成氢氧化铁的反应的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3 ,
故答案为:Cl2+SO2+2H2O═4H++SO42-+2Cl-;4Fe(OH)2+O2+2H2O═4Fe(OH)3 ;
(4)K为HCl,I是H2SO4,K和Q溶液是检验I溶液中阴离子的常见试剂,则Q是BaCl2,以Pt为电极电解1L0.1mol/LBaCl2的水溶液,阳极上氯离子放电生成氯气,电极反应式为 2Cl--2e-=Cl2↑,阴极上氢离子放电生成氢气,电极反应式为 2H++2e-=H2↑,当电路中通过0.1mol电子时,溶液中生成c(OH-)=
| ||
| 1L |
(5)C是Al、H是Fe,I是H2SO4,常温下冷的浓硫酸与铁或铝能发生钝化现象而阻止进一步被氧化,所以可用铁或铝制容器储运浓硫酸,
故答案为:冷的浓硫酸与铁或铝制容器接触时,在表面生成一层致密的氧化膜,阻止金属继续与酸反应而使金属“钝化”,所以可用铁或铝制容器储运浓硫酸.
点评:本题以Fe、Al、S及其化合物为载体考查了无机物推断,涉及铝热反应、离子方程式的书写、电解原理等知识点,综合性较强,根据物质的特殊现象、特殊性质等知识点来推断,题目难度中等.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、1.0L 1.0mo1?L-1的Na2CO3水溶液中含有的氧原子数为3NA |
| B、标准状况下,22.4L甲醇含有NA个CH3OH分子 |
| C、分子总数为NA的SO2和CO2混合气体中含有的氧原子数为2NA |
| D、25℃时pH=1的HCl溶液中含有H+的数目为0.1 NA |
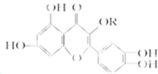 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A、可以和溴水反应 |
| B、可用有机溶剂萃取 |
| C、1mol 维生素P可以和7mol H2反应 |
| D、1mol 维生素P可以和4mol NaOH反应 |