题目内容
(1)实验室中,下列实验中所选用的仪器或操作合理的是
A.用200mL量筒量取5.25mL稀H2SO4;
B.用托盘天平称取11.7gNaCl晶体
C.用100mL烧杯配制50g质量分数约为1%的食盐水
D.用500mL容量瓶配制250mL0.20mol/L的氢氧化钠溶液
E.萃取分液时,先将上层液小心从上口倒出,再将下层液从下口流出
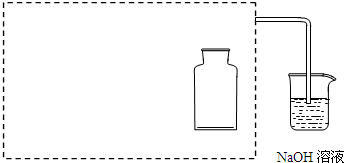
F.蒸馏时,温度计水银球放入液面以下,但不可触及瓶底或沸石
(2)实验室配制460mL0.100mol/LNa2CO3溶液回答下列问题,现有下列仪器
A.烧杯 B.100mL量筒 C.100mL容量瓶 D.药匙 E.玻璃棒 F.天平
a、配制时,必须使用的仪器有 (填代号),还缺少的仪器是 .该试验中两次用到玻璃棒,其作用分别是 , .
b、应用托盘天平称取十水碳酸钠晶体的质量为 ,若加蒸馏水不慎超过刻线,处理的方法是 .
(3)若取50.0mL上述已配好的溶液,与另一150mL0.200mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为 (设溶液的体积变化可忽略).
A.用200mL量筒量取5.25mL稀H2SO4;
B.用托盘天平称取11.7gNaCl晶体
C.用100mL烧杯配制50g质量分数约为1%的食盐水
D.用500mL容量瓶配制250mL0.20mol/L的氢氧化钠溶液
E.萃取分液时,先将上层液小心从上口倒出,再将下层液从下口流出
F.蒸馏时,温度计水银球放入液面以下,但不可触及瓶底或沸石
(2)实验室配制460mL0.100mol/LNa2CO3溶液回答下列问题,现有下列仪器
A.烧杯 B.100mL量筒 C.100mL容量瓶 D.药匙 E.玻璃棒 F.天平
a、配制时,必须使用的仪器有
b、应用托盘天平称取十水碳酸钠晶体的质量为
(3)若取50.0mL上述已配好的溶液,与另一150mL0.200mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为
考点:配制一定物质的量浓度的溶液,计量仪器及使用方法,分液和萃取
专题:实验题
分析:(1)A.用200mL量筒量取5.25mL稀H2SO4,量筒的精确度不够,应该用酸式滴定管量取;
B.因为托盘天平能准确到0.1g;
C.用天平称量食盐0.5g,用量筒量取水49.5mL,然后在100mL烧杯中溶解;
D.配制250mL0.20mol/L的氢氧化钠溶液只能用250mL容量瓶;
E.萃取分液时,先将下层液从下口流出,再将上层液小心从上口倒出;
F.蒸馏时,温度计水银球放在蒸馏烧瓶的支管口处;
(2)a.根据实验操作的步骤分析需要仪器以及玻璃棒的作用;
b.根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3?10H2O的质量;
(3)根据溶液稀释前后溶质的量不变;
B.因为托盘天平能准确到0.1g;
C.用天平称量食盐0.5g,用量筒量取水49.5mL,然后在100mL烧杯中溶解;
D.配制250mL0.20mol/L的氢氧化钠溶液只能用250mL容量瓶;
E.萃取分液时,先将下层液从下口流出,再将上层液小心从上口倒出;
F.蒸馏时,温度计水银球放在蒸馏烧瓶的支管口处;
(2)a.根据实验操作的步骤分析需要仪器以及玻璃棒的作用;
b.根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3?10H2O的质量;
(3)根据溶液稀释前后溶质的量不变;
解答:
解:(1)A.用200mL量筒量取5.25mL稀H2SO4,量筒的精确度不够,应该用酸式滴定管量取,故A不合理;
B.因为托盘天平能准确到0.1g,用托盘天平称取11.7gNaCl晶体,故B合理;
C.用100mL烧杯配制50g质量分数约为1%的食盐水,用天平称量食盐,用量筒量取水,然后在烧杯中溶解,故C合理;
D.配制250mL0.20mol/L的氢氧化钠溶液只能用250mL容量瓶,故D不合理;
E.萃取分液时,先将下层液从下口流出,再将上层液小心从上口倒出,故E不合理;
F.蒸馏时,温度计水银球放在蒸馏烧瓶的支管口处,故F不合理;
故选BC;
(2)a.配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,该试验中两次用到玻璃棒,其作用分别是搅拌 引流,
故答案为:500mL容量瓶、胶头滴管;搅拌 引流;
b.因配制溶液的体积为480ml,而容量瓶的规格没有480ml,只能选用500ml,Na2CO3的物质的量n=cV=0.5L×0.1mol?L-1=0.05mol,Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3?10H2O的质量0.05mol×286g/mol=14.3g,故答案为:14.3g;若加蒸馏水不慎超过刻线,处理的方法是 重新配制,故答案为:重新配制;
(3)若取50.0mL上述已配好的溶液,与另一150mL0.200mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为
=0.175 mol/L,故答案为:0.175 mol/L.
B.因为托盘天平能准确到0.1g,用托盘天平称取11.7gNaCl晶体,故B合理;
C.用100mL烧杯配制50g质量分数约为1%的食盐水,用天平称量食盐,用量筒量取水,然后在烧杯中溶解,故C合理;
D.配制250mL0.20mol/L的氢氧化钠溶液只能用250mL容量瓶,故D不合理;
E.萃取分液时,先将下层液从下口流出,再将上层液小心从上口倒出,故E不合理;
F.蒸馏时,温度计水银球放在蒸馏烧瓶的支管口处,故F不合理;
故选BC;
(2)a.配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,该试验中两次用到玻璃棒,其作用分别是搅拌 引流,
故答案为:500mL容量瓶、胶头滴管;搅拌 引流;
b.因配制溶液的体积为480ml,而容量瓶的规格没有480ml,只能选用500ml,Na2CO3的物质的量n=cV=0.5L×0.1mol?L-1=0.05mol,Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3?10H2O的质量0.05mol×286g/mol=14.3g,故答案为:14.3g;若加蒸馏水不慎超过刻线,处理的方法是 重新配制,故答案为:重新配制;
(3)若取50.0mL上述已配好的溶液,与另一150mL0.200mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为
| 0.1×50+0.2×150 |
| 200 |
点评:本题考查了一定物质的量浓度溶液的配制、混合等,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
相关题目
在下列所示的微粒中,氧化性最强的是( )
| A、1s22s22p2 |
| B、1s22s22p5 |
| C、1s22s22p63s1 |
| D、1s22s22p6 |
下列有关实验的叙述正确的是( )
| A、用分液的方法分离水和酒精的混合物 |
| B、容量瓶用水洗净后,可不经干燥直接用于配制溶液 |
| C、配制1L0.1mol/L的NaCl溶液时可用托盘天平称量5.85gNaCl固体 |
| D、用滴管滴加液体时,为防止液滴溅出,滴管紧贴试管内壁 |
下列变化中,需要加入氧化剂才能实现的是( )
| A、HCl→H2 |
| B、FeO→Fe2+ |
| C、SO2→SO3 |
| D、CO32-→CO2 |
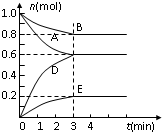 T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:
T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题: