题目内容
12.已知某烃A相对氢气的密度为42,且该烃不能使溴的CCl4溶液褪色.则A的可能结构共有(不考虑立体异构)( )| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
分析 烃A相对氢气的密度为42,则该烃的分子式为C6H12,该烃不能使溴的CCl4溶液褪色,则A应该是环烷烃结构,据此回答.
解答 解:烃A相对氢气的密度为42,则该烃的分子式为C6H12,该烃不能使溴的CCl4溶液褪色,所以不含碳碳双键,则A应该是环烷烃结构,可以是环丙烷,环上分别连着3个甲基、一个甲基一个乙基,一个丙基,一个异丙基,一个环丙烷上的一个C上有2个H,所以能被2个甲基取代,共8种;还可以是环丁烷,环上连着两个甲基(两种),一个乙基,共2种,还可以是环戊烷,环上连着一个甲基(1种),还有一种是环己烷,共12种.
故选D.
点评 本题考查学生同分异构体的书写知识,注意分子式的确定和结构简式的确定方法是关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列说法符合化学事实的是( )
| A. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| B. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 | |
| C. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
3.原子序数依次增大的短周期元素a、b、c、d,它们的最外层电子数分别为6、7、1、3.a、b、c、d形成的简单离子与氖原子电子层结构相同.下列叙述错误的是( )
| A. | 元素的非金属性顺序为a>b | |
| B. | a和c形成的离子化合物中可能含有共价键 | |
| C. | d的最高价氧化物对应的水化物可溶于c的最高价氧化物对应水化物的水溶液 | |
| D. | 五种元素离子半径最小的是d |
17.测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的实验方案不合理的是( )
| A. | 取a g混合物用酒精灯充分加热后质量减少b g | |
| B. | 取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收后质量增加b g | |
| C. | 取a g混合物与足量氢氧化钡溶液充分反应,过滤、洗涤、烘干,得b g固体 | |
| D. | 取a g混合物于锥形瓶中加水溶解,滴入1~2滴酚酞指示剂,用标准盐酸溶液滴定至终点,消耗盐酸V mL |
4.下列说法正确的是( )
| A. | 相同条件下,测得Na2CO3溶液的pH大于相同物质的量浓度的Na2SO3溶液,说明非金属性:C<S | |
| B. | 绝热容器中,向50 mL 1 mol•L-1的盐酸中加入烧碱,水的KW不变 | |
| C. | 相同温度时,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 | |
| D. | 有HX和HY两种弱酸且酸性HX>HY,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有 c(X-)>c(Y-)>c(OH-)>c(H+) |
1.四种短周期元素X、Y、Z、W的原子序数依次增大,X、W原子序数之和等于Y、Z原子序数之和.X、W两元素位于同一主族,Y元素是其所在周期中原子半径最大的元素(惰性气体元素除外),Z的单质是银白色固体,易导电,常温下不易溶于浓硫酸.下列有关推断错误的是( )
| A. | X的氢化物的沸点高于同族其他元素氢化物的沸点 | |
| B. | 阴离子还原性:X>W;阳离子氧化性:Z>Y | |
| C. | X与Y两种元素可形成含有共价键的离子化合物 | |
| D. | Z与W两种元素形成的化合物在水溶液中不能存在 |

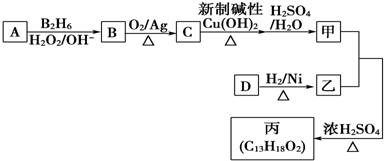
 ;
; ;
;
 $\stackrel{NaNO_{2}}{→}$
$\stackrel{NaNO_{2}}{→}$


 .
. .D→E的反应类型是氧化反应.
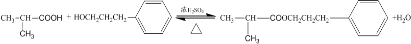
.D→E的反应类型是氧化反应. )也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有3种,写出一种X可能的结构简式
)也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有3种,写出一种X可能的结构简式 (邻、间、对位置均可).
(邻、间、对位置均可).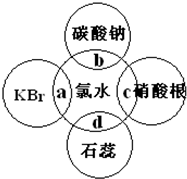 氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量).
氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量).