题目内容
19.某溶液只含以下离子中K+、Mg2+、Al3+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、SiO32-、Cl-的若干种离子,取适量该溶液进行如下实验(CO32-可与Al3+反应生成氢氧化铝)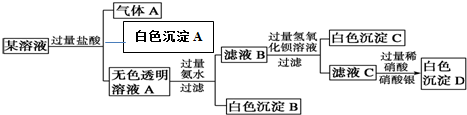
(1)此溶液一定存在的离子是K+、AlO2-、CO32-、SO42-、SiO32-
(2)肯定不存在的离子是Mg2+、Al3+、Ba2+、Fe3+
(3)不能确定是否存在的离子是Cl-
(4)写出生成沉淀A的离子方程式:2H++SiO32-=H2SiO3↓.
分析 溶液中进入过量盐酸,生成的气体A,气体A为二氧化碳,原溶液中一定存在CO32-,溶液中一定不存在Fe3+、Mg2+、Al3+、Ba2+,再根据溶液电中性可知,原溶液中一定存在唯一的阳离子K+;
加入盐酸生成了沉淀A,根据题干的离子可知,溶液中一定存在SiO32-,沉淀A为硅酸;
无色溶液甲中加入过量氨水,得到的白色沉淀,说明原溶液中一定存在AlO2-,白色沉淀乙为氢氧化铝,滤液B中存在过量的氨水,加入过量的氢氧化钡,产生的白色沉淀是硫酸钡,一定存在SO42-,滤液C中加入硝酸酸化的硝酸银,出现白色的沉淀氯化银,但是氯离子可能是开始加入的过量的盐酸中的氯离子,不能证明原溶液中的氯离子是否存在,根据以上分析进行判断.
解答 解:液中进入过量盐酸,生成的气体A,气体A为二氧化碳,原溶液中一定存在CO32-,溶液中一定不存在Mg2+、Al3+、Ba2+,再根据溶液电中性可知,原溶液中一定存在唯一的阳离子K+;加入盐酸生成了沉淀A,根据题干的离子可知,溶液中一定存在SiO32-,沉淀A为硅酸;无色溶液甲中加入过量氨水,得到的白色沉淀,说明原溶液中一定存在AlO2-,白色沉淀乙为氢氧化铝,滤液B中存在过量的氨水,加入过量的氢氧化钡,产生的白色沉淀是硫酸钡,一定存在SO42-,滤液C中加入硝酸酸化的硝酸银,出现白色的沉淀氯化银,但是氯离子可能是开始加入的过量的盐酸中的氯离子,不能证明原溶液中的氯离子是否存在.
(1)此溶液一定存在的离子是K+、AlO2-、CO32-、SO42-、SiO32-,故答案为:K+、AlO2-、CO32-、SO42-、SiO32-;
(2)肯定不存在的离子是Mg2+、Al3+、Ba2+、Fe3+,故答案为:Mg2+、Al3+、Ba2+、Fe3+;
(3)不能确定是否存在的离子是Cl-,故答案为:Cl-;
(4)沉淀A为硅酸,生成沉淀A的离子方程式:2H++SiO32-=H2SiO3↓,故答案为:2H++SiO32-=H2SiO3↓.
点评 本题考查了离子共存、常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,要求学生能够根据反应现象判断离子存在情况,试题培养了学生灵活应用所学知识的能力.

| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
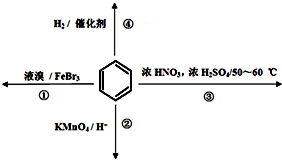
| A. | 反应①常温下不能进行 | |
| B. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| C. | 反应③为加成反应 | |
| D. | 反应④能发生,从而证明苯中是单双键交替结构 |
| A. | 若两烧杯中铝粉均已完全溶解,则两烧杯中放出氢气的量相同 | |
| B. | 若两烧杯中铝粉均未完全溶解,则盛氢氧化钠溶液的烧杯中放出氢气的量更多 | |
| C. | 若反应后,有一个烧杯中铝粉完全溶解,另一个烧杯中铝粉没有完全溶解,则那个还有铝没有溶解的烧杯原来盛着的是氢氧化钠溶液 | |
| D. | 无论如何,盐酸与铝粉反应产生的H2不可能比氢氧化钠溶液与铝粉反应产生的H2多 |
| A. | 氯水保存在棕色剂瓶中,碘保存在配有铁盖的试剂瓶中 | |
| B. | 在配制和贮存FeCl3溶液时,要加入少量铁粉,以防在空气中变质 | |
| C. | 烧碱、纯碱等碱性溶液应保存在配有玻璃塞的试剂瓶中 | |
| D. | 漂白粉、烧碱、Na2SiO3均要密封保存 |
| A. | NaNO3 | B. | Mg | C. | SO3 | D. | SiO2 |
| A. | 分类是研究物质性质的一种重要方法 | |
| B. | 许多化学定律的提出是建立在实验事实和逻辑推理基础上的 | |
| C. | 假说最终都可以变成科学理论 | |
| D. | 化学基本原理的应用是有一定条件的 |
 .
.