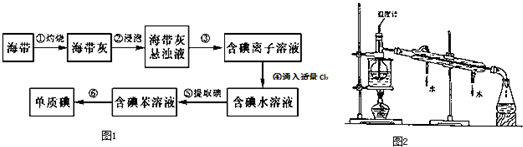
题目内容
14.下列关于物质的保存的叙述正确的是( )| A. | 氯水保存在棕色剂瓶中,碘保存在配有铁盖的试剂瓶中 | |
| B. | 在配制和贮存FeCl3溶液时,要加入少量铁粉,以防在空气中变质 | |
| C. | 烧碱、纯碱等碱性溶液应保存在配有玻璃塞的试剂瓶中 | |
| D. | 漂白粉、烧碱、Na2SiO3均要密封保存 |
分析 A.碘和铁发生反应;
B.氯化铁和铁发生反应;
C.强碱性溶液可腐蚀玻璃塞;
D.漂白粉、烧碱、Na2SiO3易在空气中变质.
解答 解:A.碘和铁发生反应,不能用铁盖,防止被腐蚀,故A错误;
B.氯化铁和铁发生反应,而导致氯化铁变质,故B错误;
C.强碱性溶液可腐蚀玻璃塞,导致玻璃塞打不开,故C错误;
D.漂白粉、烧碱、Na2SiO3易在空气中变质,应密封保存,故D正确.
故选D.
点评 本题考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,注意相关基础的积累,难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
9.表中第Ⅰ中的现象与第Ⅱ中解释或发生反应的方程式(或离子方程式)不相符合的是( )
| Ⅰ | Ⅱ | |
| A | 在淀粉KI试纸上滴几滴的FeCl3溶液,试纸变蓝 | 2Fe3++2I-=I2+2Fe2+ |
| B | 铝条置于火焰加热,看到铝熔化欲滴落,却又很快凝固 | 加热时,与O2发生反应,反应吸热 |
| C | 钠投到煤油和水的混合物中,钠粒在分界处作跳动和游动 | 钠的密度比水小比煤油大,能与水反应产生H2 |
| D | 一试管内有2V的Cl2,倒置于水中,在强光充分照射,最后试管中气体变为无色,体积为V | 因为反应Cl2+H2O?HCl+HClO 和2HClO$\stackrel{光照}{?}$2HCl+O2↑ |
| A. | A | B. | B | C. | C | D. | D |
6.下列有机物中,是l-丙醇在铜的催化作用下氧化产物的同分异构体的是( )
| A. | CH3COCH3 | B. | CH3CH2CHO | C. | CH3CH(OH)CH3 | D. | CH3CH2COOH |
3.下列变化中属于物理变化的是( )
| A. | 煤的干馏 | B. | 风化 | C. | 石油分馏 | D. | 重油裂化 |
4. “8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
(1)NaCN溶液呈碱性的原因是CN-+H2O?HCN+OH- (用离子方程式表示)
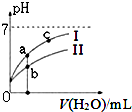
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是CDE
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN-)>c(HCOO-)>c(OH-)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN-+CO2+H2O=HCN+CO32-
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.图象中a点酸的总浓度小于b点酸的总浓度
E.图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表HCOOH或HCN)
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为KHCO3.
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验.将CN-的浓度为0,.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4,关闭活塞.
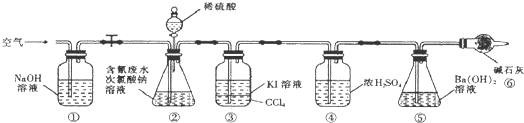
已知装置②中发生的主要反应依次为:CN-+ClO-=CNO-+Cl-2CNO-+2H++3C1O-=N2↑+2CO2↑+3C1-+H2O
(5)①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰.
(6)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
 “8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是CDE
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN-)>c(HCOO-)>c(OH-)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN-+CO2+H2O=HCN+CO32-
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.图象中a点酸的总浓度小于b点酸的总浓度
E.图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表HCOOH或HCN)
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为KHCO3.
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验.将CN-的浓度为0,.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4,关闭活塞.

已知装置②中发生的主要反应依次为:CN-+ClO-=CNO-+Cl-2CNO-+2H++3C1O-=N2↑+2CO2↑+3C1-+H2O
(5)①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰.
(6)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
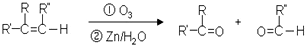
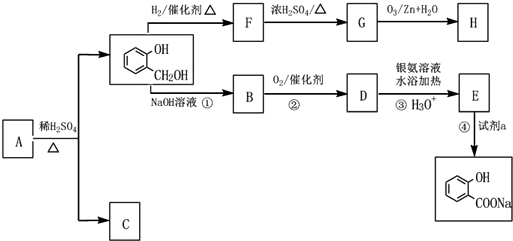
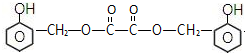 ,C俗称为草酸;
,C俗称为草酸;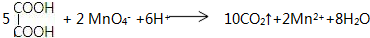 ; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式:
; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式: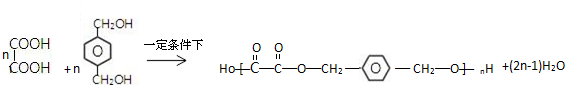 ;
; ;
;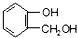 不能发生缩聚反应
不能发生缩聚反应 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验 ;
;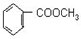 的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下:
的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下: