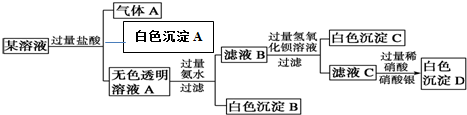
题目内容
4.根据图示回答问题:A为金属单质.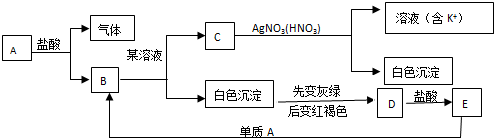
(1)写出下列各物质的化学式:
AFe、BFeCl2、CKCl、DFe(OH)3、EFeCl3
(2)写出生成D的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)E→B的离子方程式2Fe3++Fe=3Fe2+.
分析 白色沉淀先变为灰绿色,后变为红褐色生成D,则该白色沉淀为Fe(OH)2,D为Fe(OH)3.C与硝酸酸化的硝酸银溶液反应得到白色沉淀,可知C中含有Cl-,同时得到溶液中含有K+,则C为KCl.由转化关系可知E为FeCl3,A为Fe,B为FeCl2.
解答 解:(1)白色沉淀先变为灰绿色,后变为红褐色生成D,则该白色沉淀为Fe(OH)2,D为Fe(OH)3.C与硝酸酸化的硝酸银溶液反应得到白色沉淀,可知C中含有Cl-,同时得到溶液中含有K+,则C为KCl.由转化关系可知E为FeCl3,A为Fe,B为FeCl2,
故答案为:Fe;FeCl2;KCl;Fe(OH)3;FeCl3;
(2)生成D的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)E→B的离子方程式:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查无机物的推断,涉及Fe元素单质及其化合物的性质、常见离子检验等,物质的颜色及反应现象为推断突破口,熟练掌握元素化合物知识.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.配制一定物质的量浓度的溶液所使用的容量瓶上没有标明的是( )
| A. | 规格 | B. | 温度 | C. | 刻度线 | D. | 物质的量浓度 |
12.某无色的溶液中存在如下四种离子:K+、SO42-、Al3+、和M,测得它们的物质的量之比依次为n(K+):n(SO42-):n(Al3+):n(M)=2:5:2:1,则M可能是( )
| A. | NO3- | B. | Cu2+ | C. | Mg2+ | D. | Ba2+ |
9.电解是工业生产的常用方法.某研究性小组进行以下相关探究:
实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:

(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.
查阅资料显示:
化学小组分析提出:①白色物质为CuCl.
②红色物质可能有Cu(填化学式);或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2=2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是$\frac{{W}_{1}-{W}_{2}}{35.5}$.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为$\frac{20m-nV}{40}$mol•L-1.(用含m、n、v的式子表示)
实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:

(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.
查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
②红色物质可能有Cu(填化学式);或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2=2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是$\frac{{W}_{1}-{W}_{2}}{35.5}$.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为$\frac{20m-nV}{40}$mol•L-1.(用含m、n、v的式子表示)
16.在2L密闭容器中,充入2molSO2和一定量的O2,发生2SO2+O2═2SO3反应.进行到4mi n时,测得SO2为0.4mol,若反应进行到2min时,容器中的SO2为( )
| A. | 1.6mol | B. | 大于1.2 mol | C. | 大于1.6 mol | D. | 小于1.2 mol |
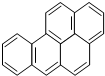 ,它是一种稠环芳香烃,其化学式为C20H12,此物质中碳元素和氢元素的质量比为20:1.
,它是一种稠环芳香烃,其化学式为C20H12,此物质中碳元素和氢元素的质量比为20:1.