题目内容
9.下列说法错误的是( )| A. | 分类是研究物质性质的一种重要方法 | |
| B. | 许多化学定律的提出是建立在实验事实和逻辑推理基础上的 | |
| C. | 假说最终都可以变成科学理论 | |
| D. | 化学基本原理的应用是有一定条件的 |
分析 A、相同类别的物质在结构和性质上有相似性;
B、化学定律通常以逻辑推理为基础;
C、假说不一定都是正确的;
D、化学基本原理的应用有一定的适用对象.
解答 解:A、相同类别的物质在结构和性质上有相似性,故研究物质的性质之前先对物质进行分类是一种重要的研究方法,故A正确;
B、化学定律通常以逻辑推理为基础,然后通过实验事实来验证,故B正确;
C、假说不一定都是正确的,很多假说经过验证证明是错误的,故C错误;
D、化学基本原理的应用有一定的适用对象,即有一定的条件,故D正确.
故选C.
点评 本题考查化学理论与研究,明确化学反应原理的内容及适用条件、范围即可解答,题目难度不大.

练习册系列答案
相关题目
20.下列化学药品名称与警示标志对应正确的是( )
| A. |  酒精 | B. |  浓硫酸 | C. |  汽油 | D. |  浓硝酸 |
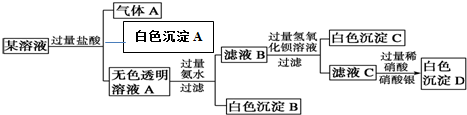
17.关于如图装置的说法正确的是( )
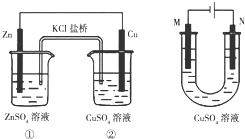

| A. | 装置①将电能转变为化学能 | |
| B. | 装置①中盐桥内的Cl-移向ZnSO4溶液 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中的Cu2+浓度保持不变 |
4. “8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
(1)NaCN溶液呈碱性的原因是CN-+H2O?HCN+OH- (用离子方程式表示)
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是CDE
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN-)>c(HCOO-)>c(OH-)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN-+CO2+H2O=HCN+CO32-
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.图象中a点酸的总浓度小于b点酸的总浓度
E.图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表HCOOH或HCN)
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为KHCO3.
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验.将CN-的浓度为0,.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4,关闭活塞.

已知装置②中发生的主要反应依次为:CN-+ClO-=CNO-+Cl-2CNO-+2H++3C1O-=N2↑+2CO2↑+3C1-+H2O
(5)①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰.
(6)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
 “8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是CDE
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN-)>c(HCOO-)>c(OH-)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN-+CO2+H2O=HCN+CO32-
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.图象中a点酸的总浓度小于b点酸的总浓度
E.图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表HCOOH或HCN)
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为KHCO3.
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验.将CN-的浓度为0,.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4,关闭活塞.

已知装置②中发生的主要反应依次为:CN-+ClO-=CNO-+Cl-2CNO-+2H++3C1O-=N2↑+2CO2↑+3C1-+H2O
(5)①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰.
(6)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
1.钢铁是铁和碳的合金的总称,其强度高、价格便宜、应用广泛.在以下关于不锈钢和普通钢的认识中,你认为正确的是( )
| A. | 他们的组成元素是相同的 | |
| B. | 耐腐蚀的性能不同 | |
| C. | 它们都属于钢,因此物理性质相同 | |
| D. | 构成普通钢和不锈钢的主要元素都是铁,因此它们的化学性质相同 |
18.生产、生活中离不开各类化学物质.下列化学物质中属于盐类的是( )
| A. | 苏打 | B. | 铁红 | C. | 水晶 | D. | 生石灰 |
8.下列有关实验的说法正确的是( )
| A. | 若用标准盐酸滴定待测 NaOH 溶液,滴定前仰视,滴定后俯视则测定值偏大 | |
| B. | 可用 pH 试纸测定新制氯水的 pH | |
| C. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| D. | 向白色 ZnS 沉淀上滴加 CuSO4溶液,沉淀变为黑色,说明 Ksp(ZnS)<Ksp(CuS) |