题目内容
(12分)某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链。其主要工艺如下:

(1)写出工业上电解食盐水反应的化学方程式 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式: 。
(3)已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH= ,反应2Mg+TiCl4 2MgCl4+Ti在Ar气氛中进行的理由是 。
2MgCl4+Ti在Ar气氛中进行的理由是 。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中正极上的电极反应式是 ,负极区的pH (填“增大”、“减小”、“不变”)。
(1)2NaCl+2H2O Cl2↑+H2↑+2NaOH (2)2FeTiO3+6C+7Cl2
Cl2↑+H2↑+2NaOH (2)2FeTiO3+6C+7Cl2 2TiCl4+2FeCl3+6CO;
2TiCl4+2FeCl3+6CO;
(3)-512 kJ/mol(2分,没单位给1分)防止高温下Mg(Ti)与空气中的O2(或CO2、N2)反应;
(4)O2+2H2O+4e-=4OH-,减小
【解析】
试题分析:(1)工业上电解食盐水反应的化学方程式是2NaCl+2H2O Cl2↑+H2↑+2NaOH;(2)根据图示可知钛铁矿经氯化法得到四氯化钛的化学方程式是2FeTiO3+6C+7Cl2
Cl2↑+H2↑+2NaOH;(2)根据图示可知钛铁矿经氯化法得到四氯化钛的化学方程式是2FeTiO3+6C+7Cl2 2TiCl4+2FeCl3+6CO;(3)①×2—②,整理可得:2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH=-512 kJ/mol;在高温下Mg(Ti)与空气中的O2(或CO2、N2)反应为了防止Mg及反应产生的Ti与空气中的成分反应,反应2Mg+TiCl4
2TiCl4+2FeCl3+6CO;(3)①×2—②,整理可得:2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH=-512 kJ/mol;在高温下Mg(Ti)与空气中的O2(或CO2、N2)反应为了防止Mg及反应产生的Ti与空气中的成分反应,反应2Mg+TiCl4 2MgCl4+Ti在Ar气氛中进行;(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中正极上发生还原反应,该电极反应式是O2+2H2O+4e-=4OH-,负极上发生反应: CH3OH-6e-+ 8OH-=CO32-+ 6H2O,由于不断消耗OH-,产生水,所以溶液中c(OH-)减小,因此该电极区的pH减小。
2MgCl4+Ti在Ar气氛中进行;(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中正极上发生还原反应,该电极反应式是O2+2H2O+4e-=4OH-,负极上发生反应: CH3OH-6e-+ 8OH-=CO32-+ 6H2O,由于不断消耗OH-,产生水,所以溶液中c(OH-)减小,因此该电极区的pH减小。
考点:考查反应方程式的书写、反应条件的控制、电极反应式的书写、溶液酸碱性的判断、原电池反应原理的应用的知识。

 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大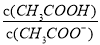 的值减小
的值减小 Fe3O4+S4O62-+2H2O。下列说法正确的是
Fe3O4+S4O62-+2H2O。下列说法正确的是