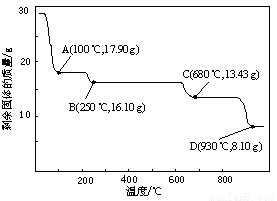
题目内容
下列关于元素周期表和元素周期律的说法正确的是
A.ⅥA族元素的原子半径越大,越容易得到电子
B.I A族与VIIA族元素间能形成离子化合物也能形成共价化合物
C.I A族元素的金属性比ⅡA族元素的金属性强
D.原子最外层电子数为2的元素一定位于元素周期表中的ⅡA族
B
【解析】
试题分析:A、ⅥA族元素的原子半径越大,非金属性越弱,越难得到电子,A错误;B、I A族与VIIA族元素间能形成离子化合物,例如氯化钠,也能形成共价化合物例如氯化氢等,B正确;C、同周期I A族元素的金属性比ⅡA族元素的金属性强,不同周期的不一定,例如钙的金属性强于锂等,C错误;D、原子最外层电子数为2的元素不一定位于元素周期表中的ⅡA族,也可能是0族的He或是过渡元素等,D错误,答案选B。
考点:考查元素周期表的结构与元素周期律的应用

在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)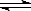 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态 (填是或否)处于平衡状态?若不是,反应向哪个方向进行?
下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2 min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
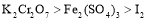
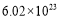
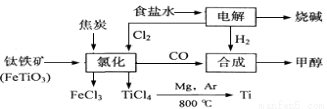
 2MgCl4+Ti在Ar气氛中进行的理由是 。
2MgCl4+Ti在Ar气氛中进行的理由是 。