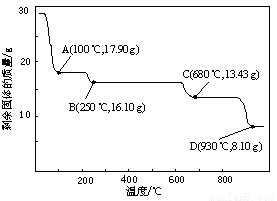
题目内容
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.常温下,23 g NO2含有氧原子的数目为NA
B.1.00 mol·L-1 NaCl溶液中含有Na+的数目为NA
C.标准状况下,39 g苯中含有的碳碳双键数为1.5NA
D.常温常压下,22.4 L乙烯中含C-H键的数目为4NA
A
【解析】
试题分析:A.常温下,23 g NO2的物质的量是0.5mol,故含有氧原子的数目为NA,正确;B.只有溶液的浓度而没有溶液的体积,因此不能确定微粒数目的多少,错误;C标准状况下,39 g苯的物质的量是0.5mol,,但是苯分子中没有碳碳双键,是一种介于碳碳单键和碳碳双键之间的一种独特的化学键,错误;D.常温常压下,22.4 L乙烯的物质的量小于1mol,因此其中含C-H键的数目小于4NA,错误。
考点:考查阿伏加德罗常数的计算的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2 min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
(14分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)空气阴极法电解制备H2O2的装置如下图所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物。

试回答:
①直流电源的a极名称是 。
②阴极电极反应式为 。
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下制得了H2O2。相对于电解法,该方法具有的优点是安全、 。
(2)Fe3+对H2O2的分解具有催化作用。利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。

(3)用H2O2 和H2SO4 的混合溶液可溶解印刷电路板金属粉末中的铜。反应的离子方程式是 ,控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
Cu的平均溶解速率 (×10-3mol·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
 O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2 O2(g)===
O2(g)===  H2O(l) ΔH5; 2H2(g)+O2(g)===2H2O(l) ΔH6
H2O(l) ΔH5; 2H2(g)+O2(g)===2H2O(l) ΔH6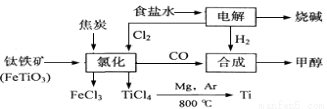
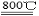 2MgCl4+Ti在Ar气氛中进行的理由是 。
2MgCl4+Ti在Ar气氛中进行的理由是 。 A.乙烯的结构简式:CH2=CH2 B.二氧化硫分子比例模型:
A.乙烯的结构简式:CH2=CH2 B.二氧化硫分子比例模型: